2022年8月全球最新获批药品和器械清单
声明:本文为火石创造原创文章,欢迎个人转发,分享,网站、公众号等转载需经授权。
2022年8月,全球批准新药数量持续平稳。FDA批准8款新药(NDA/BLA),包含0款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),2款生物制品药物(BLA),其中CIMERLI是全球首个FDA批准的可互换生物类似药;EMA新授权3款药品上市,其中2款新活性物质(NAS);NMPA批准3个品规(1个品种)创新药上市,属生物制品,为神州细胞的瑞帕妥单抗注射液。
医疗器械方面,FDA有1个通过上市前批准(PMA)途径首次上市的产品。境内公示了10个三类医疗器械进入创新审批绿色通道,批准了7个创新器械上市,境内医疗器械审批集中在体外诊断试剂,共1034项,占33.31%。
一全球药品获批情况
(一)美国FDA批准情况
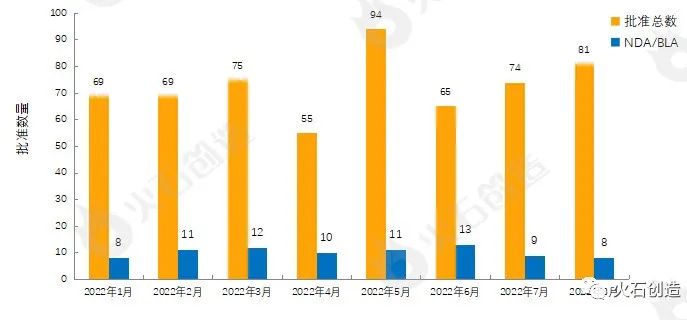
图1 2022年1—8月FDA药物批准数量变化情况
来源:美国食品药品监督管理局
如图1,截至2022年9月7日FDA官网披露,2022年8月FDA共完成81项药品首次批准(不包含暂时批准),其中NDA/BLA批准8款(不包含暂时批准),见表1。其中包括0款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),2款生物制品药物(BLA)。
其中CIMERLI是全球首个FDA批准的可互换生物类似药,被批准可与诺华Lucentis(ranibizumab注射剂)互换,适用于Lucentis在美国获批的所有适应症;AUVELITY是首款获批用于抑郁症治疗的口服NMDA(N-甲基D-天冬氨酸)受体拮抗剂,同时也是60年来抑郁症治疗的里程碑式新突破,其为45mg右美沙芬与105mg安非他酮的缓释复方组合;赛诺菲旗下公司GENZYME CORP的创新酶替代疗法药物XENPOZYME是首个也是唯一一款获批专门用于治疗酸性鞘磷脂酶缺乏症(ASMD)的药物,其于2022年3月和6月,分别获日本厚生劳动省、欧盟批准上市。
表1 2022年8月FDA批准NDA/BLA药物列表
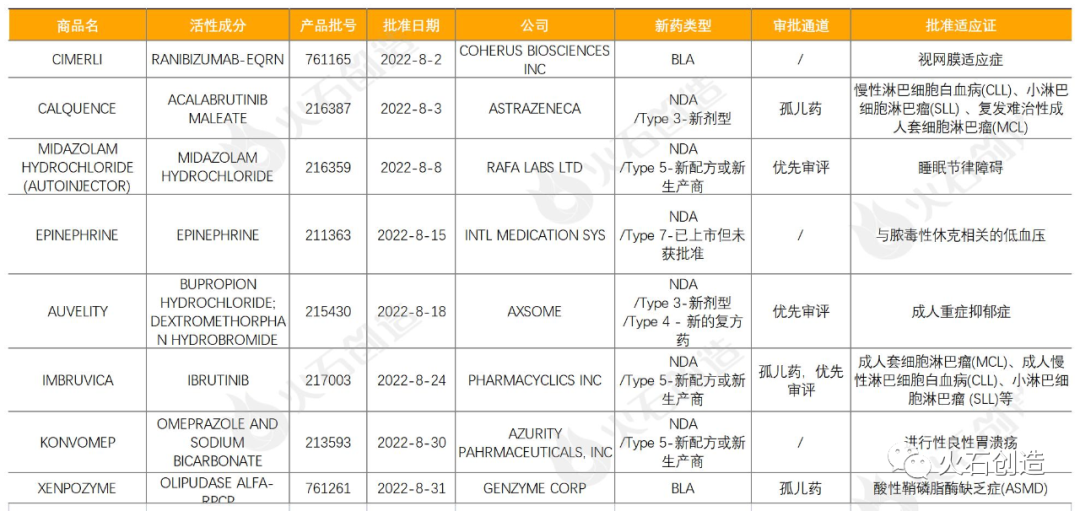
来源:美国食品药品监督管理局
(二)欧盟EMA批准情况
截至2022年9月7日EMA官网披露,2022年1月至8月的推荐上市药品及新活性物质(NAS)数量情况见图2。2022年8月EMA未推荐药品上市。

图2 2022年1—8月EMA推荐上市药品数量变化情况
来源:火石创造产业数据中心
截至2022年9月7日,EMA在8月新授权3款药品上市,见表2。
其中吉利德的Sunlenca(lenacapavir)是一款first-in-class的衣壳抑制剂,对其他现有药物没有已知的交叉耐药性,为现有抗病毒治疗耐药的 HIV 感染者提供每六个月一次的长效新治疗选择;Roctavian是全球首款血友病腺相关病毒(AAV)基因疗法,此次欧盟附条件批准其上市,用于治疗那些没有凝血因子Ⅷ抑制剂史且没有可检测到的AAV5型抗体的严重血友病A型患者。
表2 2022年8月EMA授权药物列表
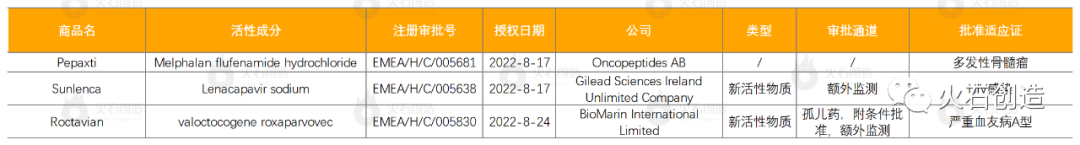
来源:火石创造产业数据中心
(三)NMPA批准情况
截至2022年9月7日NMPA披露,2022年8月共批准国产首次注册药品60件。按剂型去重后,共42个药品品种(不同厂家生产同一药物按同一品种计算)。本月有3个品规(1个品种)1类创新药获批,属生物制品。2022年8月NMPA批准的1类创新药情况见表3。
表3 NMPA批准的1类创新药获批列表
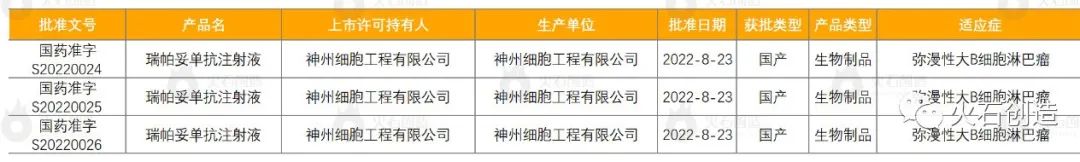
来源:国家药品监督管理总局
瑞帕妥单抗注射液是神州细胞自主研发的一种人鼠嵌合IgG1型抗CD20单克隆抗体,用于治疗弥漫性大B细胞淋巴瘤(DLBCL)。DLBCL是最常见的非霍奇金淋巴瘤类型,是一种进展迅速的侵袭性疾病,对于这类患者,抗CD20单抗是基石治疗药物。目前瑞帕妥单抗的获批将为更多患者提供一种新的治疗选择。
(四)仿制药一致性评价情况
截至2022年9月7日CDE官网披露,CDE共承办药品一致性评价受理号4176个,2022年8月共新增承办84个受理号。截至2022年9月7日,共4626个品规上市药品通过一致性评价(包含视同通过1945个品规),本月共73个品规的药品通过一致性评价(包含视同通过13个品规),按剂型去重后,共45个药品品种。
目前一致性评价品种通过的注射剂共 1670个品规(254个品种),本月过评药品中共计47个品规(27个品种)的注射剂。2022年1月至8月通过一致性评价数量见图3。

图3 2022年1—8月仿制药一致性评价批准数量变化情况
来源:国家药品监督管理总局
二、全球医疗器械获批情况
(一)美国FDA批准情况
截至2022年9月7日,8月FDA共批准259个510(k)途径的产品,其中一类器械19个,二类器械236个,未分类4个。
通过对510(k)上市前通知的器械根据美国医学专业用途进行分类,结果发现,8月产品获批类型最多的为骨科器械、一般医院和个人使用类器械、一般和整形手术器械、放射科器械与心血管器械,见图4。

图4 2022年8月通过FDA 510(k)途径获批上市产品类型分布情况
来源:美国食品药品监督管理局
2022年8月有1个通过上市前批准(PMA)途径首次上市的产品。
表4 2022年8月PMA首次批准的器械
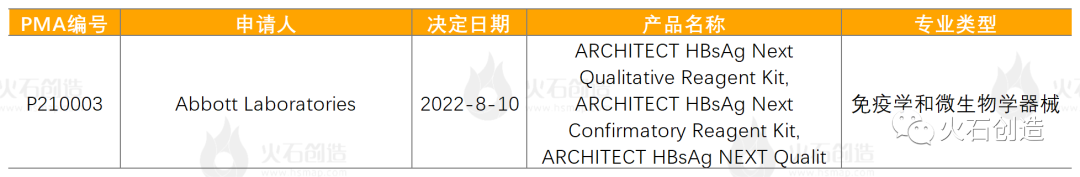
来源:美国食品药品监督管理局
(二)境内批准情况
截至2022年9月7日,2022年8月国家局公示了10个三类医疗器械进入创新审批绿色通道,见表5。
表5 2022年8月进入绿色通道的三类创新器械

来源:国家医疗器械审评中心
截至2022年9月7日,2022年8月国家局公示了7个三类创新器械获批上市,见表6。
表6 2022年8月获批上市的三类创新器械
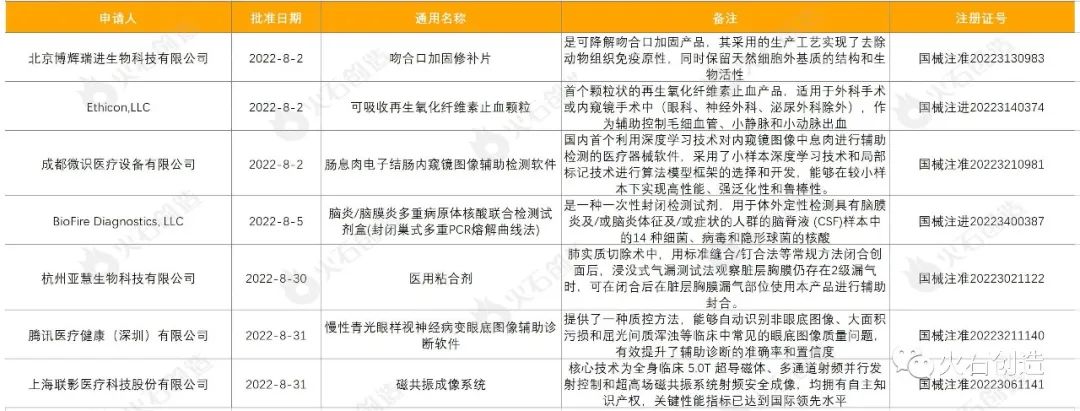
来源:国家医疗器械审评中心
截至2022年9月7日,2022年8月国家局共批准首次注册三类医疗器械产品191个,其中国产164个,进口27个。各省级药品监管部门8月共批准国产第二类医疗器械注册1261个,一类备案医疗器械1570个。
统计数据显示,体外诊断试剂数量最多,共1034项,占33.31%,基本上均为国产,为1019项。除体外诊断试剂,批准注册类别数量排前三位的分别为注输、护理和防护器械,临床检验器械和口腔科器械。
表7 2022年8月国产、进口医疗器械批准注册类别数目分布情况

来源:国家医疗器械审评中心
从地域分布上,2022年8月国产二、三类注册产品批件最多的依次为广东省(299件)、江苏省(219件)、湖南省(203件)三个区域,见图5。

图5 国产获批器械区域分布
来源:火石创造产业数据中心
—END—
作者 | 火石创造 毛琦琼
审核 | 火石创造 刘辉兴 殷莉
原文标题 : 盘点 | 2022年8月全球最新获批药品和器械清单

图片新闻
最新活动更多
-
5月31日立即报名>> 【线下论坛】新唐科技2024未来创新峰会
-
8月27-29日马上报名>>> 2024(第五届)全球数字经济产业大会暨展览会
-
精彩回顾立即查看>> 莎益博多物理仿真技术介绍及案例在线研讨会
-
精彩回顾立即查看>> 智能医疗设备测试的挑战
-
精彩回顾立即查看>> OFweek 2024(第十三届)中国机器人产业大会
-
精彩回顾立即查看>> 中科煜宸水导激光国产设备RJ305新品发布会
-
6 创新药进入证伪期







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论