君联医疗全球新药资讯速递 · 第28期
本周要点
本周新药数据共9个,其中肿瘤4个,神经1个,呼吸1个,心血管1个,消化1个,血液1个。
Biogen治疗阿尔茨海默病的在研疗法aducanumab在今年三月终止实验后,宣告复活,预计明年向FDA递交BLA申请,受此消息刺激,biogen的股价飙升40%,对于$40B市值的企业,这种股价波动非常罕见。AD这个领域此前一直被视为被诅咒的土地,埋葬了无数新药的梦想,在这个赛道下注的企业很多都是怀着go big的梦想但只能接受 go home的结果。不过虽然Aducanumab这次卷土重来声势浩大,但不少人也质疑现有结果更多是数据分析的胜利,而不是药效的重大突破,未来审批的前景仍不明朗。但aducanumab只要获批,预计就会加冕新一代药王。
罗氏宣布Tecentriq(阿特珠单抗)联合Avastin(贝伐珠单抗)治疗既往肝细胞癌患者的3期临床研究达到了两个终点,T+A方案在OS和PFS方面相比索拉非尼有明显提升,这是索拉非尼后首个一线能够提升肝癌OS数据的方案,堪称历史里程碑事件(是的,乐伐替尼也仅是达到OS非劣)。肝癌治疗此前一直被索拉非尼垄断,虽然疗效欠佳,但众多挑战者都在头对头实验中被斩于马下。这几年终于有柳暗花明趋势,乐伐替尼上位一线不久后,K+乐伐的combo便将ORR提升到45%左右,现在T+A更是获得OS的显著获益。未来新药若想在肝癌领域有所作为,仅仅将索拉非尼作为竞争对手已经是不够了。
药物研发动态
Biogen宣布2020年初提交阿尔茨海默病新药上市申请
Biogen和日本卫材宣布在与FDA协商后,计划将在2020年初向FDA提交阿尔茨海默病药物aducanumab的生物制品许可上市申请,并将继续与欧洲、日本等地区的监管机构进行协商
药物机理
aducanumab是Biogen和与日本药企卫材(Eisai)公司合作开发的生物蛋白疗法,靶向β淀粉样蛋白,这是一种在大脑中形成块状斑的蛋白质,被认为是导致这种疾病的原因
入组标准与实验设计
对III期临床研究中较大的数据集进行分析,包括3285例患者,其中2066例患者有机会完成整个18个月的治疗
结果
认为研究达到了其主要终点,患者临床认知衰退显著减少;接受高剂量的患者亚群的分析结果也支持了其研究结果。接受aducanumab治疗的患者在认知和功能指标如记忆、定向和语言方面显著获益
Aducanumab作用机制
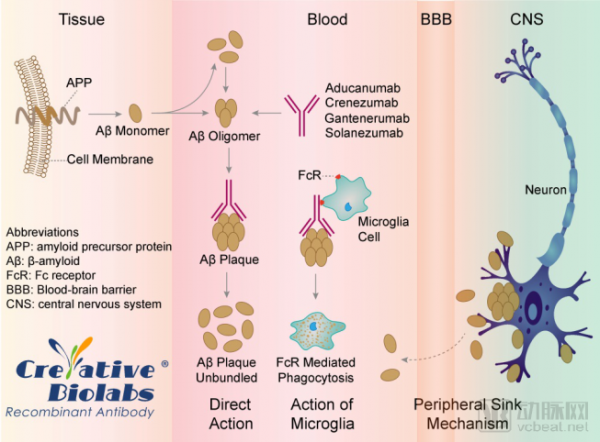
数据来源:creative biolabs
阿斯利康达格列净获批新适应症用于降低心衰风险
阿斯利康宣布FDA已批准达格列净用于降低患有2型糖尿病和其他心血管疾病风险的成年人因心力衰竭而住院的风险,目前正在中国进行监管审查,预计于2020年上半年作出决定
药物机理
达格列净是口服SGLT2抑制剂,SGLT2是肾脏内协助葡萄糖重吸收的转运蛋白。达格列净通过抑制SGLT2的功能,让更多葡萄糖从尿液中排走,从而降低血液中的葡萄糖水平
入组标准与实验设计
随机双盲安慰剂对照的多中心3期研究,评估达格列净与安慰剂相比,对具有心血管事件风险的成年2型糖尿病患者在心血管结局上的效果
结果
达格列净与安慰剂相比,心力衰竭或心血管死亡这一主要复合终点的风险显著降低了17%,心力衰竭风险显著降低了27%,各患者亚组的治疗获益均一致
Alexion长效C5补体抑制剂Ultromiris获批用于治疗非典型溶血尿毒综合征
Alexion 宣布FDA批准Ultromiris用于治疗非典型溶血尿毒综合征患者(年龄一个月以上)的补体介导血栓性微血管病,这是Ultomiris首次获批用于治疗儿科患者
药物机理
Ultomiris是一种长效C5补体抑制剂,它通过抑制补体级联通路的效应蛋白C5来抑制补体信号通路的激活,患者只需每8周接受一次注射就可以有效抑制补体信号通路的激活
入组标准与实验设计
基于两项全球性,单臂开放标签研究的结果,其中包括一项成人临床试验和一项儿科患者临床试验
结果
在最初为期26周的疗程后,54%的成人患者和71%的儿童患者出现血栓性微血管病(TAM)的完全缓解
杨森Stelar获FDA批准溃疡性肠炎新适应症
杨森公司宣布FDA批准Stelara(乌司奴单抗)用于治疗成人中重度活动性溃疡性肠炎
药物机理
Stelara是IL-12/IL-23生物制剂靶向疗法,是首个获批用于治疗溃疡性肠炎、以内窥镜检查评估黏膜改善的终点指标评估后发现对小肠内壁具有改善作用的治疗药物
入组标准与实验设计
包括两个阶段,诱导期患者接受一次静脉注射Stelara 6mg/kg,8周之后进入维持期,患者接受皮下注射Stelara 90mg,每8周一次,为期44周
结果
诱导治疗阶段,受试组19%患者在8周后实现临床缓解,其中58%患者同时实现了症状缓解。维持治疗阶段,45%患者在治疗1年后实现临床缓解,其中有43%不再需要使用糖皮质激素药物
罗氏T+A免疫联合疗法达到OS终点
罗氏官网首曝Tecentriq(阿特珠单抗)联合Avastin(贝伐珠单抗)治疗既往未接受过系统治疗的不可切除的肝细胞癌(HCC)患者的3期临床研究IMbrave150达到了两个主要终点
药物机理
Secuado是非典型抗精神病药物asenapine的透皮皮贴剂疗法。Noven公司开发的透皮给药系统(TDDS)可以在给药的24小时内维持血液中的药物浓度。
入组标准与实验设计
纳入501例未接受过全身治疗的不可切除HCC患者,以2∶1的比例随机分配接受Tecentriq+Avastin联合治疗或目前的肝癌标准疗法索拉非尼治疗。共同主要终点OS、IRF、PFS,次要终点包括ORR、TTP和DOR,以及 PRO、安全性和药代动力学
结果
达到了两个主要终点,证明与标准治疗索拉非尼相比,T+A方案在总生存期(OS)和无进展生存期(PFS)方面都达到了具有统计学意义和临床意义的提升
诺华哮喘新药fevipiprant 3期临床失败
诺华宣布旗下哮喘缓解剂fevipiprant在两项3期临床(ZEAL 1和ZEAL 2)中,与安慰剂相比,fevipiprant均未能改善患者肺功能
药物机理
Fevipiprant是一款DP2拮抗剂,DP2是参与驱动过敏性哮喘炎症过程的受体,该类哮喘药物能够治疗极少数不受控制形式的哮喘患者
入组标准与实验设计
招募了约700名病情未能有效控制的哮喘患者,随机将他们分组接受除标准治疗外的每日一次fevipiprant或安慰剂治疗,主要终点是12周后患者肺功能FEV1的变化
结果
与安慰剂相比,fevipiprant均未能改善患者肺功能。至于该药物有没有在试验中达到次要终点,诺华并没有做出说明,包括跟踪患者白天哮喘症状评分和生活质量在内的指标

图片新闻
技术文库
最新活动更多
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> 【线下论坛】新唐科技2025新品发布会
-
精彩回顾立即查看>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论