国产PD-1单抗第一梯队,君实生物完成“新三板+H+科创板”上市
7月15日,上海君实生物医药科技股份有限公司(以下简称:君实生物)正式挂牌科创板。这也是继登陆新三板、港交所之后,君实生物第三次上市。近5年来,君实生物成为资本的“宠儿”,累计融资超过70亿元。
其科创板首日开盘价为216元/股,截至发稿其总市值达1550.87亿元。据招股书,君实生物此次发行价格为55.5元/股,本次发行的股票数量为8713万股,募集资金达27亿人民币。
君实生物是一家创新驱动型生物制药公司,从事创新药物的发现和开发,并在全球范围内开展临床研发及商业化。值得注意的是,该公司手握首个国产抗PD-1单克隆抗体——特瑞普利单抗(商品名拓益),该产品也是君实生物目前唯一获批上市的药品。
该公司核心管理与技术团队有较强的研究背景和行业经验。其中,公司执行董事、行政总裁李宁拥有预防医学/生物统计博士学位,曾任FDA审评主任、赛诺菲副总裁等;首席运行官冯辉拥有医学博士学位,曾在多个创新药企业任科学家等职位。
根据君实生物财报,其2019年全年实现营业收入7.75亿元,较2018年的93.4万元实现暴增,增幅达829倍。而在2020年一季度,君实生物实现营收1.72亿元,同比增长117.7%,规模与同行公司相比较小,但业绩放量速度显著高于同行。
与此同时,该公司的研发费用也在快速增长,2017-2019年公司研发支出年复合增长率 85.38%,仅2019年其研发开支达到9.46亿元,较2018年增加75.8%,主要为关键临床试验的不断推进及合作研发及授权许可项目的引进。
自2012年成立到2019年末,君实生物已累计亏损20.05亿元。根据最新披露的业绩预告,2020年1-6月预计其亏损6.8亿元-5.6亿元,亏损幅度同比扩大199.97%-93.46%,亏损扩大的原因是销售收入还无法覆盖研发费用等支出。
为了突破融资瓶颈,君实生物选择回归生物科技公司扎堆的科创板“输血”。
类修美乐和PCSK9抑制剂在研,仅PD-1药物实现商业化
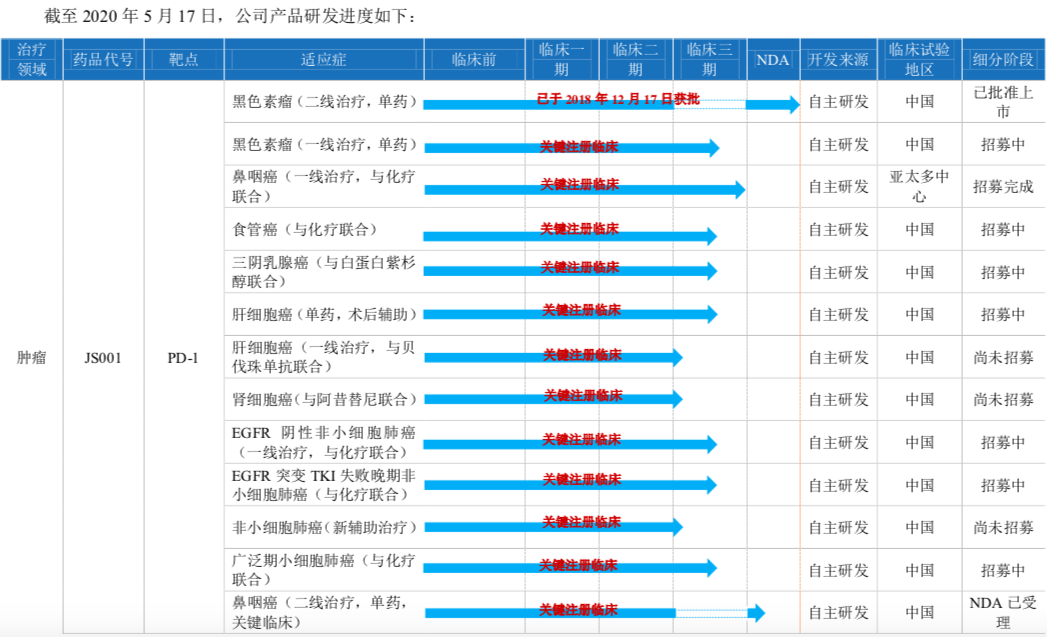
君实生物处于生物医药行业下的创新药细分领域。在产品管线方面,君实生物共有21项在研产品,13项为自主研发的原创新药,8项与合作伙伴共同开发。其研发管线涉及肿瘤、代谢疾病、自身免疫和神经系统等,其中肿瘤是君实生物重点布局的领域。除了上述的PD-1以外,君实生物的肿瘤药涵盖了PD-L1、BTLA、CTLA-4等热门靶点。



图片来自君实生物招股书
君实生物唯一实现商业化的核心产品是“特瑞普利单克隆抗体注射液”(重组人源化抗PD-1单克隆抗体注射液),于2018年12月获批上市,是国内首个获批上市的国产PD-1单克隆抗体注射液,具有先发优势。目前它仅有一项适应症获批,即既往标准治疗失败后的局部进展或转移性黑色素瘤。
除特瑞普利单抗上市外,君实生物还有2款产品处于临床试验后期阶段。其中,UBP1211是一款与泰康生物合作开发的修美乐生物类似药。于2019年11月7日获得NDA受理通知书,为当前12款在研抗TNF-α单抗中第3个提交NDA的产品。
根据弗若斯特沙利文的报告,中国修美乐生物类似药市场规模将于2023年达到47亿元,预计2030 年增长至115亿人民币,该产品市场规模巨大,可以容纳多家公司的市场竞争。
另外一款药物是JS002,它是由君实生物自主研发的注射用重组人源化抗PCSK9单克隆抗体,用于治疗心血管疾病,正处于II期临床试验阶段。目前全球市场有伊洛尤单抗(安进)、阿利珠单抗(赛诺菲/再生元)2款抗PCSK9单抗获批上市,礼来、信达生物、恒瑞医药、信立泰和康方生物的相关产品均处于临床试验阶段。
根据方正证券的数据,君实生物的特瑞普利、修美乐生物类似药和PCSK9抑制剂三大核心产品约有超过230亿元的估值。
除了以上三款产品,君实生物还有3款first-in-class新药研发中。其中,目前因疫情最备受关注的是它与中国科学院微生物所共同开发的新冠病毒中和抗体(JS016)。6月7日,JS016获得国家药品监督管理局药品审评中心批准进入Ⅰ期临床试验,并完成首例受试者给药,这是全球首个在健康受试者中开展的新冠病毒中和抗体临床试验。
另外两款first-in-class产品包括抗肿瘤抗BTLA单抗(JS004),这由君实生物自主研发、在同类中首个获得全球临床试验批准,正在中、美两地开展I期临床试验;另一款是与国外药企合作开发引进IL-21融合蛋白产品(JS014),目前在全球尚未有同类产品获批。
不断拓展的研发管线,也让君实生物的研发费用大幅增长。根据其2017年-2019年的财报,君实生物的研发费用分别为2.7亿元、5.4亿元和9.5亿元。但由于仅有一款商业化的产品,再加上特瑞普利单抗的销售还未进入顶峰而是处于爬坡阶段,它的销售收入还补不上研发管线的资金“窟窿”。以2020年第一季度为例,君实生物的研发费用2.17亿元,同比增长11.86%,而特瑞普利单抗一季度的销售额1.72亿元。
不可避免的,和研发费用同步增长的是它的亏损。和其他创新药企业一样,君实生物也面临盈利难的问题。其招股书披露,2017年-2019年,该公司净利润分别为-31,757.08万元、-72,285.42万元及-74,772.88万元,并且在报告期内亏损呈扩大趋势。
而登陆科创板,能够很大程度上缓解君实生物研发资金“输血”难的困局。
赛道竞争激烈,特瑞普利单抗的风险和机会
特瑞普利单抗的上市销售激活了君实生物的内在“供血”系统。根据其财报数据,2019年,君实生物的营业收入达7.75亿元,同比增长26.38%;亏损额达7.47亿元,亏损较2018年有所收窄。同年它的研发投入为9.46亿元,同比增长75.8%。其中,自2019年2月,特瑞普利单抗开出首张处方到2019年末,特瑞普利单抗的销售额达7.74亿元,占据了君实生物2019年99.99%的主营收入。
特瑞普利单抗几乎以“一己之力”支撑起了君实生物的营收,因此存在产品集中度较高的风险。短期来看,特瑞普利仍将是公司收入和利润的主要来源。如果特瑞普利的经营环境发生重大变化、销售产生波动、临床开发进度不达预期,都将对公司的经营业绩和财务状况产生不利的影响。
另外,其核心产品特瑞普利单抗所在的PD-1/L1赛道已经相当拥挤。目前,全球市场(除中国市场外)共有 Keytruda、Opdivo 和 Libtayo 三个 PD-1 单抗药物上市,。国内市场已有六款产品获批,包括 Opdivo、Keytruda、 拓益、达伯舒、艾瑞卡和百泽安。
除此之外,国内不少企业也都在奋起直追。根据弗若斯特沙利文,截至2020年3月31日,国内有1款 PD-1单抗(誉衡药业的GLS-010 注射液)递交上市申请,有5个PD-1单抗药物在临床 III 期,同时共有 26 个针对 PD-1 单抗的 III 期单药试验和 70 个针对 PD-1 单抗的 III 期联合治疗试验正在开展。随着后续同类药物或类似药的获批上市, 市场竞争风险加剧将一定程度上影响公司的经营业绩。
除了残酷的外部竞争环境,特瑞普利单抗还面临着拓展适应症的紧迫需求。目前在国内四大PD-1药物中,恒瑞医药的卡瑞利珠单抗已获批4项适应症,百济神州的替雷利珠单抗则为2项适应症。而君实生物的特瑞普利单抗目前仍然是当时上市时获批的黑色素瘤适应症。
而这个适应症所对应的国内销售市场十分有限。根据弗若斯特沙利文分析,2019 年中国黑色素瘤新发病人数仅为7563人,发病率较低。2019 年新发黑色素瘤病人中,既往标准治疗失败后的局部进展或转移性黑色素瘤患者仅2400人。
即便放眼全球市场,黑色素瘤本就规模有限的市场中已有至少3款PD-1药物,其中包括Keytruda和Opdivo。另外,信达生物的信迪利单抗和恒瑞医药的卡瑞利珠单抗针对治疗黑色素瘤的临床试验也分别进入了Ⅰ期和Ⅱ期。
从小适应症转型大适应症,也是创新药企业构建壁垒的有效路径。君实生物也在积极布局其PD-1单抗药物拓展到大的适应症。
今年5月,特瑞普利针对治疗既往接受过二线及以上系统治疗失败的复发/转移鼻咽癌适应症和治疗既往接受过系统治疗的局部进展或转移性尿路上皮癌适应症已向NMPA提交 NDA 申请并获受理,同时正在进行针对包括黑色素瘤、鼻咽癌、食管癌、三阴性乳腺癌、非小细胞肺癌等多个适应症的III期临床试验。目前,特瑞普利单抗正在开展超20项临床试验,其中包括14项关键注册临床试验。
随着后期多项药物的研发进入收获期,按照君实生物的预期,2021-2023年它可能进入业绩增长的爆发期。这期间,特瑞普利的多项适应症以及另一重磅品种PCSK9抑制剂都有望通过审批上市。
作者: 秘丛丛 来源:亿欧

图片新闻
技术文库
最新活动更多
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> 【线下论坛】新唐科技2025新品发布会
-
精彩回顾立即查看>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论