微卫星不稳定(MSI)检测首证落地,肿瘤个性化治疗将变革?
从临床的肿瘤诊疗从放、化疗时代过渡到靶向、免疫治疗时代开始,按照生物标记物划分肿瘤类型,逐渐成为一种与传统的按原发器官分类并行的肿瘤区分方式。在越来越多的肿瘤新药适应症里,已经不会简单罗列*期*癌,而是出现了如EGFR基因突变的III期肺癌、HER2基因突变的III期乳腺癌等字样。
2017年,FDA批准帕博利珠单抗用于治疗 dMMR/MSI-H 型不可切除或转移性经治的实体瘤患者。这是全球首个直接根据生物标记物划定适应症的泛癌种肿瘤药物,让微卫星不稳定(MSI)这一热门的肿瘤免疫标记物得到了监管层的官方认证。
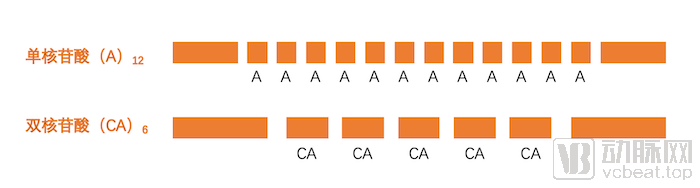
微卫星,即人类基因组中的短串联重复序列(STR),包括单核苷酸的重复、双核苷酸的重复,甚至更多核苷酸的重复。微卫星遍布人类基因组中,目前知道的微卫星已经达到1900万个左右。
基因组中的微卫星示意图
1997年,美国国家肿瘤研究所(NCI)首次对MSI进行了定义。与正常组织相比,肿瘤组织中由微卫星重复单元的插入或缺失所导致的微卫星长度的改变,称为微卫星不稳定,是肿瘤中常见的第5种突变类型,MSI-H肿瘤即指具有微卫星高度不稳定表型的肿瘤。
据统计,2015年,中国有约450万癌症新发病例。对于被检测为MSI-H的患者,其适用的肿瘤治疗方案往往与没有发生这类突变的患者不同,因此,国内越来越多的基因检测公司开始为肿瘤患者提供MSI检测服务,但一直没有监管批准的MSI检测产品上市。
这种状况持续到2021年。1月下旬,国家药品监督管理局(NMPA)批准了桐树基因申请的“微卫星不稳定(MSI)检测试剂盒(多重荧光PCR-毛细管电泳法)”,该试剂盒是国内首个获得NMPA批准的微卫星不稳定检测试剂盒,在临床上为医生制定个体化诊疗方案提供参考依据。成立4年,桐树基因擒获MSI检测首证,背后是一条怎样的注册报批之路?首证落地,MSI检测和肿瘤精准医疗将发生如何变革?近日,动脉网对桐树基因创始人严令华进行了专访,尝试解答这些问题。
MSI-H人群疾病负荷大,临床病理特征独特
我们谈及肿瘤基因突变,通常是指点突变、插入/缺失、融合和扩增。这类基因突变往往造成某一两个基因功能异常,从而引发其所在的通路信号传递异常,恶性肿瘤就在这个过程中发生、发展。MSI-H肿瘤也有相似的产生逻辑,但更为复杂。
处于编码区的MSI导致移码突变,会触发相关基因功能失活,由于微卫星数量庞大且遍布整个基因组,因此位于多个基因上的微卫星不稳定将会导致与肿瘤相关的多个信号通路中的多个基因功能异常,进而导致MSI-H肿瘤的发生发展。
MSI-H 的表型最早是在遗传性结直肠癌中被发现,但后来的研究发现,MSI-H 肿瘤发生于多个部位中,最常见的发生部位为结直肠、子宫内膜和胃,同时也发生于其他部位。

各个癌种的MSI-H患者比例
如果根据各个癌种MSI-H的发生率估算,每年新发MSI-H肿瘤患者达到30多万,这个数字与每年新发乳腺癌病例数相当,远高于前列腺癌、甲状腺癌、卵巢癌、淋巴瘤等其他高发肿瘤。与此同时,不同MSI-H肿瘤患者在临床病理、分子病理方面往往具有相似的特征。

MSI-H肿瘤与其他癌种年新发病理数比较 数据来源:JCO Precis Oncol
例如,有研究表明,MSI多发生在II期结直肠癌、近端结肠,并且MSI-H型肿瘤具有分化较差、伴有粘液成分、淋巴管血管、T细胞浸润等临床病理上的特征。同时,MSI-H肿瘤是具有分子共性的,研究表明,MSI的现象多见于KRAS野生型、BRAF突变型、PIK3CA突变型,TMB-H的患者中,且特定的通路MMR、WNT、PI3K和NOTCH的基因突变在MSI-H肿瘤中存在富集现象,这与肿瘤起源的部位是无关的。也就是说,MSI-H肿瘤是一类独特的肿瘤,拥有一套独有的分子发生机制,并具备特殊的临床/分子病理特征。
由此可见,以MSI作为区分肿瘤类型的生物标志物,一方面能够找出数量庞大的同类型患者,这些患者具有差异化的肿瘤治疗需求;另一方面,带有MSI-H生物标志物特征的肿瘤患者,通常具有相似临床病理、分子病理特征,可以帮助临床医生制定、优化针对MSI-H型肿瘤患者的完整治疗方案。这也是MSI检测的临床价值日益受到重视的底层逻辑。
MSI检测的4大临床价值
MSI检测最早被用在林奇综合征的筛查中。林奇综合征曾被称作遗传性非息肉病性结直肠癌((Hereditary non-polyposis colorectal cancer,HNPCC),是遗传性肿瘤中发生率最高的一类。MSI 检测可以作为林奇综合征的初筛手段,对于确定为MSI-H 的患者,则采用林奇综合征致病基因MMR的胚系突变检测,来明确诊断。
此外,MSI检测在临床上被广泛应用在结直肠癌、胃癌等肿瘤的预后判断和辅助化疗疗效预测中,筛选出需要在手术后接受进一步化疗的患者。
近年来,MSI检测最热门的一项应用,便是肿瘤免疫治疗的响应预测。
丁香园在《微卫星不稳定百科全书》中介绍,微卫星不稳定会产生大量的移码突变(Frameshift mutation),导致阅读框变化,造成下游的一系列密码子改变,产生完全不同的肽链,也被称为“移码肽”(Frameshift peptides,FSP)。这些移码肽作为新抗原,具有高度的免疫原性,引起肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TIL)的免疫应答,由此可见,这也是 MSI-H 肿瘤对免疫治疗敏感的原因之一。其次,MSI-H肿瘤通常伴有高肿瘤突变负荷(Tumor Mutation Burden,TMB),而高TMB也是免疫治疗敏感的标志之一。
2015年的一项临床研究首次证明,MSI-H 型的结直肠癌患者能够从帕博利珠单抗的治疗中获益。后续的多项临床研究更是将能够响应免疫治疗的MSI-H患者拓展到超过10种肿瘤。换言之,MSI检测被证明是一种泛癌种的肿瘤免疫响应预测手段。
到2020年,最新公布的KEYNOTE-177 研究结果显示,相较于化疗,帕博利珠单抗作为 MSI-H转移性结直肠癌的一线治疗方案具有临床意义和统计学意义。这一研究结果,进一步扩大MSI检测在肿瘤免疫响应预测中的应用范围。在美国国立综合癌症网络(NCCN)的结直肠癌诊疗指南中,已经把MSI检测作为选择一线治疗方案的必要程序,并在超过10种肿瘤中,推荐采用MSI检测进行免疫响应预测。

主要癌种的MSI临床应用场景数据
严令华指出,理论上,所有确诊的结直肠癌患者、确诊的胃癌患者、确诊的子宫内膜癌患者、确诊的小肠腺癌患者、需进行林奇综合征筛查的肿瘤患者、寻求免疫治疗的所有实体瘤患者,都有必要做MSI检测。其中,早期患者主要采用MSI检测进行预后判断、林奇综合征筛查和辅助化疗,晚期患者则主要用MSI检测来做免疫响应预测。“
前期,由于没有注册的产品上市,MSI检测主要通过LDT(临床实验室自建项目)的方式来完成,全国每年只能做到10万例左右。严令华告诉动脉网,“这对于30万MSI-H患者的覆盖十分有限,我们预计临床MSI检测的需求每年有150万例。”
合理的MSI检测,微卫星位点检测Panel的选择是关键
在 MSI 诊断中,检测位点(Panel)的设置,往往决定了检测结果的假阳性率或者假阴性率。国际上权威的MSI检测Panel有两个,一个是NCI Panel,由 2 个单核苷酸位点(BAT-25 和 BAT-26)和 3 个双核苷酸位点(D2S123、D5S346 和 D17S250)组成,也就是著名的2B3D Panel。另一个是Pentaplex Panel,包括5 个单核苷酸微卫星位点,BAT-25、BAT-26、NR-21、NR-22和NR-24。
桐树基因从2016年末开始联合国内头部的肿瘤学科专家,开展MSI相关的临床研究,已经积累下超过2万例MSI检测患者数据,发表近30篇学术论文。在严令华看来,这些研究成果最核心的意义在于,验证了2B3D Panel在中国人群MSI检测中的有效性,为更多MSI检测产品设计提供循证依据。
“尽管2B3D是许多国际指南认定的权威Panel,但支撑这些共识的都是基于欧美人群的研究数据,中国人群的遗传性特征是不一样的。”严令华指出,“桐树基因用了3项临床研究来回答中国人群应该采用哪种MSI检测Panel的问题。”3项临床研究分别是,NCI Panel与Promega Panel的头对头比较分析;NCI Panel、Promega Panel与24个位点Panel的对比研究;MSI检测与显微切割对比的肿瘤异质性研究。
临床研究表明,中国人群的NCI Panel敏感性相比Promega Panel高18%,24位点Panel的敏感性最低。也就是说,MSI检测的位点选择并不是越多越好,而是要选择经过验证的位点,从而提升检出率。桐树基因的第三项临床研究表明,MSI检测几乎不受肿瘤异质性影响,验证了MSI检测可以提供更高质量的临床证据。
对于桐树基因MSI检测的Panel设定,严令华的把关或许有点严苛。经过大规模的临床检验后,严令华才最终敲定开发基于2B3D NCI Panel的MSI检测试剂,在这期间,桐树基因没有向患者开放商业化的MSI检测服务,坚持临床研究的客观性。“Panel选择是MSI检测开发的关键,这个环节出现问题,就很难保证产品品质。”严令华强调。
目前,《中国临床肿瘤学会(CSCO)结直肠癌诊疗指南 2020 版》、《结直肠癌分子标志物专家共识》(2018 版)、《遗传性结直肠癌临床诊治和家系管理中国专家共识》(2018 版)及《ESMO 共识:肿瘤免疫治疗中的微卫星不稳定检测建议及其与 PD-1/PD-L1 表达和肿瘤突变负荷的关系》(2019 版)等多个国内外指南和共识,都推荐用2B3D NCI Panel进行MSI检测。
据了解,桐树基因抽调了科研、医学、产品等部门的近20人团队,专门从事MSI检测临床研究。除了前述3项关键的Panel研究外,桐树基因还开展了覆盖约3000名MSI-H患者的肿瘤发生率研究,探索结直肠癌、胃癌、子宫内膜癌、肝癌、脑胶质瘤等癌种患者的MSI-H比率。MSI-H患者的肿瘤发生率研究是一个冷门领域,但却为指导临床肿瘤精准医疗提供了重要的参考。此外,桐树基因布局了MSI-H患者的PD-1用药前瞻性临床研究。从已经入组的患者治疗情况看,MSI检测与PD-1疗效具有明确的相关性。
用“120分”的产品去申报注册
严令华坦言,从成立桐树基因之初,他想做的就是合规的检测产品。在严令华看来,IVD企业应该定位于为医生提供好用的检测工具,只有服务好了医生,才能最终造福患者。MSI检测是其中一个方向。
桐树基因开发MSI检测产品的初心,与严令华父亲的患癌经历不无关系。10多年前,严令华的父亲被诊断出患有晚期胃癌。在手术后的6段辅助化疗刚刚进行到第2段时,父亲不良反应非常严重。严令华敏锐地意识到,父亲可能是MSI-H患者,接受辅助化疗的效果可能并不好。后来的检测验证了严令华的猜测,父亲于是停止了辅助化疗,现在的健康状况依然很好。“当时,我确信,MSI检测是真的是广大胃肠肿瘤患者所需要的,”严令华说,“我们的目标是让每位需要做MSI检测的患者接受合格的MSI检测。”
所以在选定2B3D NCI Panel、启动相关验证之后,桐树基因也第一时间与监管层、临床专家沟通,要证明在大规模的临床应用中,试剂盒的准确率可以达到99%,甚至100%。“严令华表示,”这就意味着,从研发阶段开始,就要做出100分,乃至120分的产品,否则到注册检验阶段注定会失败。“
桐树基因提交的注册申报材料中包含1000余例患者临床试验数据,但是早期的引物选择、方法学验证则实施了上万例的MSI检测。根据监管层的要求,桐树基因采用多种对照方法对MSI检测试剂盒进行了验证,包括一代测序、IHC(免疫组化)、NGS(二代测序)。
在临床实践中,除了PCR+毛细管电泳的金标准方法可以评估MSI状态,IHC也常用于MMR蛋白的检测,间接反映MSI的状态。
MSI 状态由 MMR 蛋白功能异常导致,IHC法的原理通过对 MMR 系统中 4 个主要的蛋白(MLH1、MSH2、MSH6 及 PMS2)表达的检测来反映 MSI 的状态。IHC 方法成本低、耗时少,在国内医疗机构病理科的普及性较高。有研究显示,IHC 和PCR+毛细管电泳法的一致性可以达到 85% 以上。
不过,IHC 判读识别对病理医师要求很高,检测结果容易受判读人员的主观因素影响,产生假阴性和假阳性。此外,IHC 检测的一抗选择对阳性和阴性的判断至关重要,操作流程难以标准化和规范化,从而无法保证 IHC 结果的可重复性,影响检测结果。因此,严令华认为,将PCR+毛细管电泳法与IHC法相结合,是现有条件下更可靠的MSI检测方式。

不同技术路径的MSI检测对比
近年来,随着分子生物学发展和NGS测序成本的降低,全外显子组测序和多基因靶向区域测序逐渐也应用于 MSI 的检测中。NGS 通量大,灵敏度高,采用NGS Panel一次性可以检测上千个 MSI 位点、MMR 基因状态及其他分子标志物。但在严令华看来,由于 NGS 数据分析更为复杂,需要明确统一的算法及评判标准对 MSI 进行评估,而这种检测方式进入临床应用,则需要更多中国人群的数据积累和验证。
MSI产品初步定型后,桐树基因的临床试验设计历时近半年。这期间,他们反复与行业内的专家沟通,用前期积累的研究数据一家一家敲定参与注册临床试验的医疗机构。
严令华告诉动脉网,他十分感谢桐树基因MSI产品注册申报的这段经历,也从中学到了很多,“这个过程体现了所有人都本着为患者负责的态度,我们就应该这样去做。“
从10万例到150万例
接受动脉网专访的时候,距离NMPA正式批准桐树基因的MSI检测产品上市已经过去了一周,严令华仍难掩激动。“这个产品获批,必然会深刻改变MSI检测市场,但是我认为更重要的是,MSI-H患者距离更精准的临床治疗方案又进了一步。”严令华说到,“首先是稳定性,把MSI检测放到医院内来做,肯定是更可靠的。其次是时效性,以往MSI检测把样本外送,集中检测后传回结果,中间需要4~5天,而院内的MSI检测最快当天就能出结果。”
试剂盒上市后,MSI检测也将在临床场景中发挥更大的价值。以肿瘤免疫响应预测为例,按照国家卫健委要求,应选择取得相关资质的检测试剂来指导抗肿瘤药物的使用。选择免疫治疗的肿瘤患者往往病情危重,药物价格也较高,采用合规的MSI检测,对医生和患者都形成保护。
目前,桐树基因已经整合了20人的商务团队,在未来2~3年中,将MSI检测试剂送到全国的医疗机构中。据严令华预测,国内能够提供MSI检测的医疗机构至少有200家,如果按照每家医疗机构每年完成1000~1500例MSI检测计算,MSI检测试剂将成为肿瘤精准医疗领域年需求量最大的检测单品。
从目前临床医生沟通的结果看,MSI检测临床需求非常强烈,只是迟迟没有合规产品上市,很多医院很难选择。产品注册证落地后,桐树基因已经陆续接到了许多医疗机构的采购意向。“所以产品注册证落地,会为MSI检测样本量从10万例提高到150万例输出强劲动力。”严令华推测,首证发出后,或有更多的MSI检测试剂,将充分满足临床对MSI检测的需求。
对于桐树基因而言,获得MSI检测产品注册证,是精准医疗创新和探索的一个重要节点,但远不是终点。严令华表示,接下来,在大力推动MSI检测试剂快速覆盖临床需求的同时,桐树基因会在肿瘤精准医疗的另外两个方向持续发力,争取未来实现ctDNA和大Panel肿瘤NGS检测的关键突破。
写作参考:
丁香园:《微卫星不稳定百科全书》
肿瘤时间:微卫星不稳定-不能忽视的肿瘤指标
春雨医生:结直肠癌微卫星不稳定性(MSI)检测及其临床意义
作者:王世薇

图片新闻
技术文库
最新活动更多
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> 【线下论坛】新唐科技2025新品发布会
-
精彩回顾立即查看>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论