腺相关病毒在基因治疗的进展和未来应用
前言
基因治疗是目前最火热的治疗领域之一,因为它针对的是疾病的潜在致病原因而不仅仅是症状。该疗法可以诱导病变细胞中的基因表达或沉默,并已在临床前试验中取得成功,但其临床应用依然受到基因载体免疫原性、致癌性、脱靶效应和疗效的限制。
基因治疗成功的关键考虑因素是用于传递治疗性核酸以表达或沉默基因的载体。重组病毒已被用作基因治疗载体,在细胞摄取、基因整合和长期基因表达方面更为有效,尤其是在体内,但是它们具有免疫原性、潜在的致癌作用和繁琐的制造过程。为了解决这些局限性,人们开发了能够避免免疫反应、具有广泛的可调节性和质量控制的非病毒载体,但它们的转染效率低,并导致转基因的被动表达。
腺相关病毒(AAV)在基因治疗方面的发展势头越来越大,越来越多的临床试验将其用于各种治疗。截至目前,FDA批准的基于AAV的基因疗法包括Sparktherapeutics的Luxturna和Avexis的药物Zolgensma,分别用于治疗遗传性视网膜疾病和脊髓性肌萎缩症。AAV因其较低的免疫原性和位点特异性整合能力被认为具有更好的安全性。然而,抗AAV的中和抗体在大多数人群中普遍存在,这限制了AAV的系统应用。人们目前的研究重点集中在工程化的AAV,通过对其衣壳进行分子修饰、与小分子和聚合物偶联和络合以及包装在各种人工和天然载体(包括囊泡、水凝胶和聚合物)中,用于提高安全性、疗效和多模式治疗。使用AAV载体进行的临床试验的结果也强调了开发有效、安全和通用的载体在实现理想的基因治疗方面的关键作用。
AAV的历史与病毒学
AAV最早发现于20世纪60年代,被认为是腺病毒培养的污染物。然而,随着发现AAV只有在腺病毒存在下才能复制,以及后来的单纯疱疹病毒1型(HSV-1)的存在,腺病毒和AAV之间的联系很快建立起来。在确定AAV可以转化哺乳动物细胞后,研究人员开始生产重组AAV(rAAV)。含有腺病毒DNA的质粒可以独立于辅助病毒复制AAV。这一发现推动了该领域的发展,并真正开启了AAV的基因治疗领域。
AAV是一种小的、无包膜的细小病毒,在20-25nm的衣壳中基因组大小为?4.7kbp。基因组分为复制(REP)和衣壳蛋白质(CAP)的两个编码区,基因组两端都有反向重复序列(ITR)。REP编码与感染、整合和复制有关的四种蛋白质,Rep40、Rep52、Rep68和Rep78,而CAP编码三种蛋白,VP1,VP2和VP3,它们分别以1:1:10的比例组成AAV的60-mer衣壳。VP3是最丰富的,构成了外壳结构的外部,而VP1和VP2构成内部。

AAV不能独立复制,只有在辅助病毒(如腺病毒、单纯疱疹病毒、痘苗病毒)存在时,才能进行复制和溶细胞性感染,否则只能建立溶源性潜伏感染。AAV将其基因组整合到19号染色体上的一个特定位置,即AAVS1,或在染色体外独立复制。AAV是非致病性的,即使在其自然状态下也不会引起任何疾病;此外,它没有系统的固有性免疫反应。总共发现了12种天然的AAV衣壳血清型,并命名为AAV1-AAV12,它们显示出优先与体内特定组织结合的特性。
AAV不仅能感染活跃分裂的细胞,而且能感染静止的细胞,这使得它对许多病毒和非病毒载体对基因传递不敏感的细胞群特别有价值,例如视网膜细胞和神经元细胞。AAV感染静止细胞的自然能力促进了基因治疗的许多显著进步,例如FDA批准的治疗Leber先天性黑朦的Luxturna(Spark Therapeutics)。
临床上批准的基于AAV的基因治疗药物
在过去的20年中,基于AAV载体的基于治疗在临床转化中的相关性不断提高,目前占全球基因治疗临床试验的8.1%。
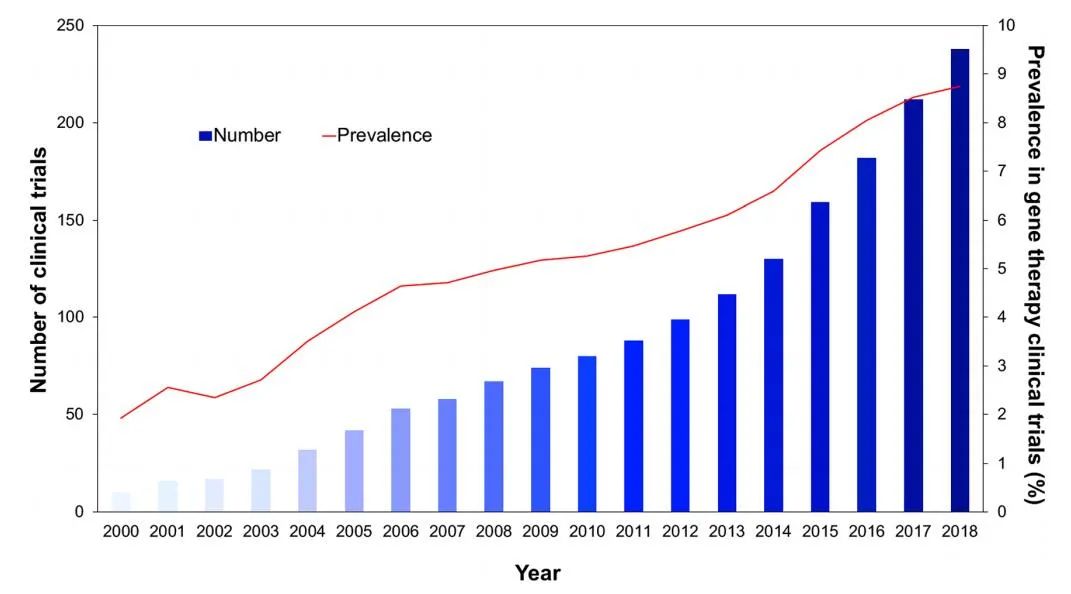
第一个批准在欧洲临床使用的基于AAV的基因治疗药物是alipogene tiparvovec(AT),用于治疗脂蛋白脂酶缺乏症(LPLD),这是一种罕见的常染色体隐性疾病。该药物于2012年获得批准,商品名为Glybera。AT基因疗法提供LPL基因的变体,LPLS447X,以纠正LPL患者LPL的功能。在III期临床试验中,给药AT后14周,低脂饮食后乳糜微粒的峰值水平降低了79%。
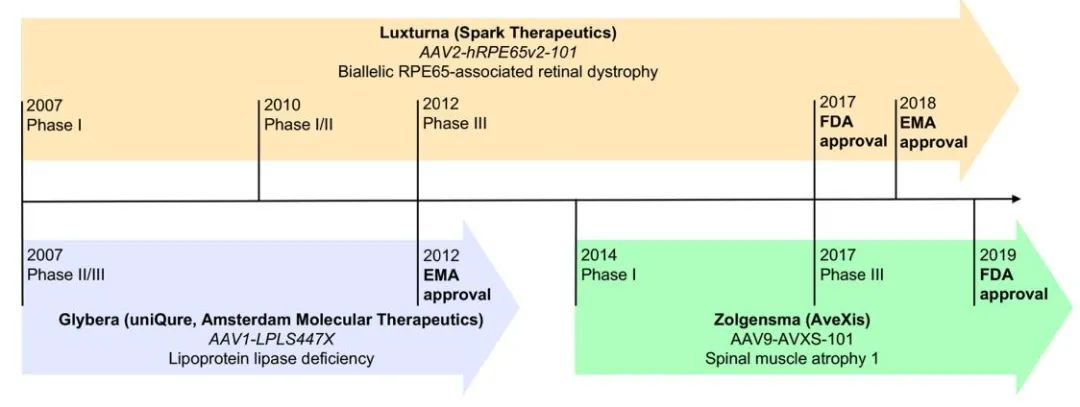
目前有17种美国FDA批准的基因疗法,包括AAV载体voretigene neparvovec rzyl(VN),由Spark Therapeutics于2017年开发,商品名为Luxturna。VN包含一个包裹RPE6基因的AAV2,用于治疗双等位基因RPE65相关的视网膜营养不良症,一种罕见的遗传性疾病,导致视功能受损,随年龄增长而下降,最终导致失明。在2012年进行的III期临床试验中(NCT00999609),Leber先天性黑朦2型患者接受视网膜下注射VN 1年后,65%的参与者获得最大改善。在VN获批之前,还没有治疗视网膜营养不良的药物。
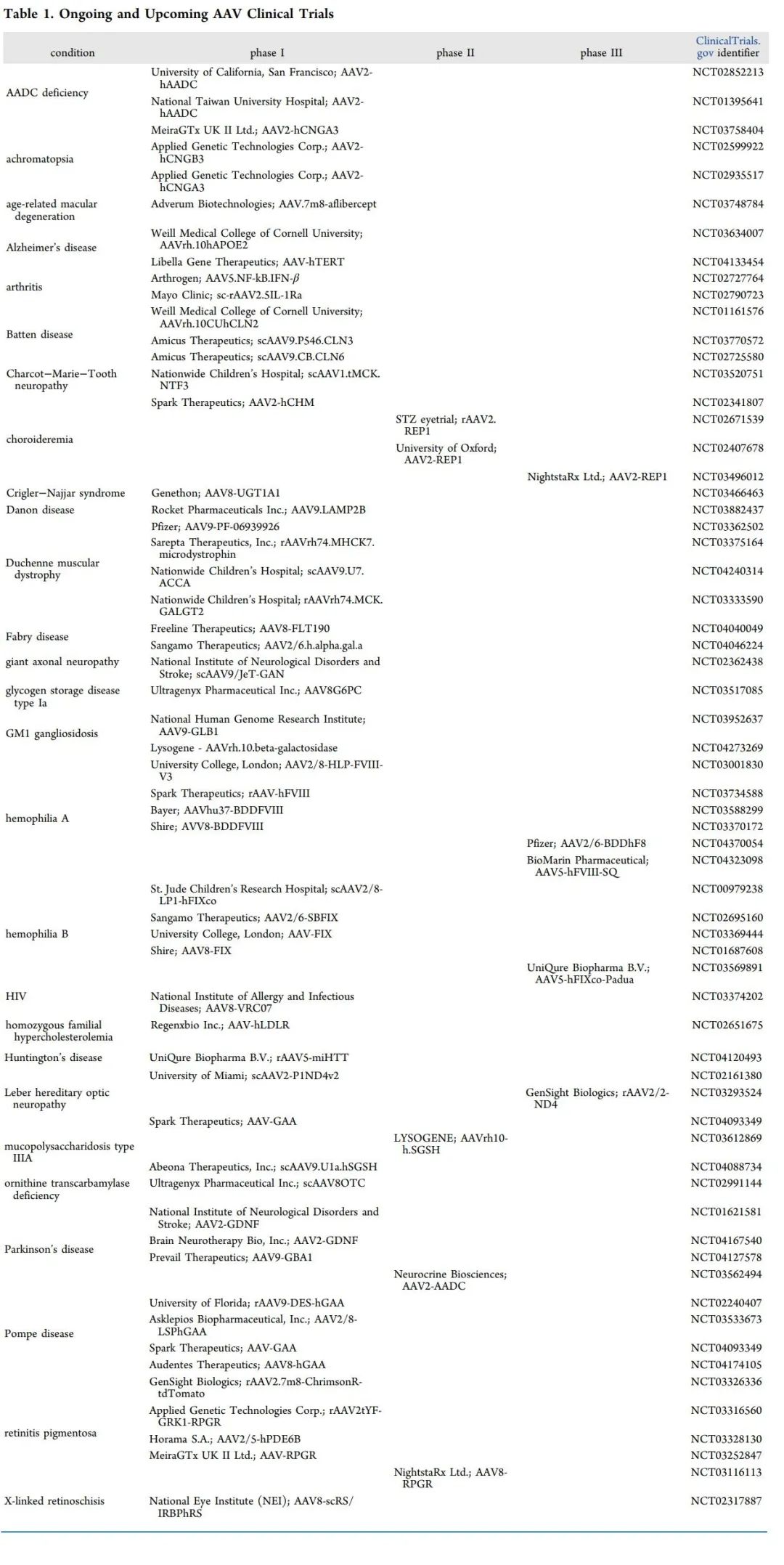
2019年获得FDA批准的第二种基于AAV的基因疗法是Onasemogene abeparvovec xioi(OA),由AveXis开发,商品名为Zolgensma。OA利用表达功能性SMN1转基因的AAV9治疗2岁以下儿童的I型脊髓性肌萎缩症(SMA1)。SMA1的特点是脑干和脊髓的运动神经元丢失,导致运动功能严重受损,并最终因呼吸衰竭死亡。它是导致婴儿死亡的最常见单基因遗传性疾病。在2017年一项名为STR1VE的三期临床试验中(NCT03306277),接受治疗后, 91%的患者在14个月时仍无需永久性呼吸支持,50%的患者在18个月时能够独立静坐。下表列出了正在进行和即将进行的基于AAV的临床试验。
应用AAV的治疗干预策略
最常见的AAV介导的治疗干预是基因置换,其特点是引入基因的功能拷贝来治疗单基因疾病。这种方法主要用于罕见和不可治疗的疾病,是上述两种FDA批准的AAV基因治疗的基础。基因置换的另一个显著例子是正在进行的治疗严重血友病A的临床试验,血友病A是凝血蛋白因子VIII缺乏症。它是一种隐性的X连锁疾病,在美国有三分之一的病例可由自发突变引起,在美国大约每5000个新生儿中就有1个发生这种疾病。在使用AAV治疗血友病A的临床试验的中,有三家预计将于2020年底或2021年初开始第三阶段临床试验(NCT04323098,NCT04370054,NCT03734588)。
基因添加是AAV基因治疗最广泛的应用,因为它可以用来治疗更常见的非单基因的复杂疾病,如慢性、自身免疫性或感染性疾病。AAV用于基因添加的例子包括正在进行的治疗类风湿关节炎的临床试验。目前,Arthrogen正在进行1期临床试验(NCT02727764),AAV载体携带IFN-β的转基因,一种在骨和软骨保护中起作用的抗炎介质。
与试图克服功能缺失突变的基因置换不同,基因沉默,也称为RNA干扰(RNAi),可以用来沉默有害的功能增益突变。在这种方法中,AAV转基因对miRNA前体进行编码,该前体由靶细胞自身的RNAi机制处理,以产生miRNA,一种小的非编码RNA链,能够与mRNA内的互补序列进行碱基配对以抑制其表达。使用AAV进行基因沉默的大多数努力仍在临床前研究中,因为沉默有几个特定的安全问题必须解决。一个主要问题是非靶点沉默的可能性。另一个问题是RNAi饱和的机制,在这种机制中,转基因miRNA的表达可能压倒并破坏内源性miRNA的产生,从而导致细胞毒性。目前,uniQure已经开始使用AAV基因疗法治疗亨廷顿病的临床试验(NCT049493)。
AAV应用的挑战
大多数成功的用于临床前和临床研究的AAV仅限于天然的衣壳血清型,但这些AAV血清型在临床上的广泛应用存在明显的局限性。抗AAV的中和抗体的存在仍然是全身输送的一个重要障碍,这些中和抗体干扰AAV进入靶细胞、细胞内运输和细胞核内的解包装,从而阻止了转导。为了更好地了解接触AAV所产生的免疫反应,已经进行了一些研究,检查了产生的IgG亚类,发现它们主要是IgG1。流行病学研究表明,在30-60%的人群中可发现血清阳性率不同的中和抗体。这些中和抗体中最流行的是针对AAV2的,其次是AAV1。
AAV介导的基因治疗的另一个问题是基因组(4.7kbp)的大小限制,包括ITRs,给转入的基因只留下一个?4.5kbp的大小空间,这将其靶向适应症缩小到只能是那些小片段转基因的表达。
工程化AAV
AAV可以通过衣壳修饰、表面偶联和封装进行设计,以解决天然AAV的局限性。
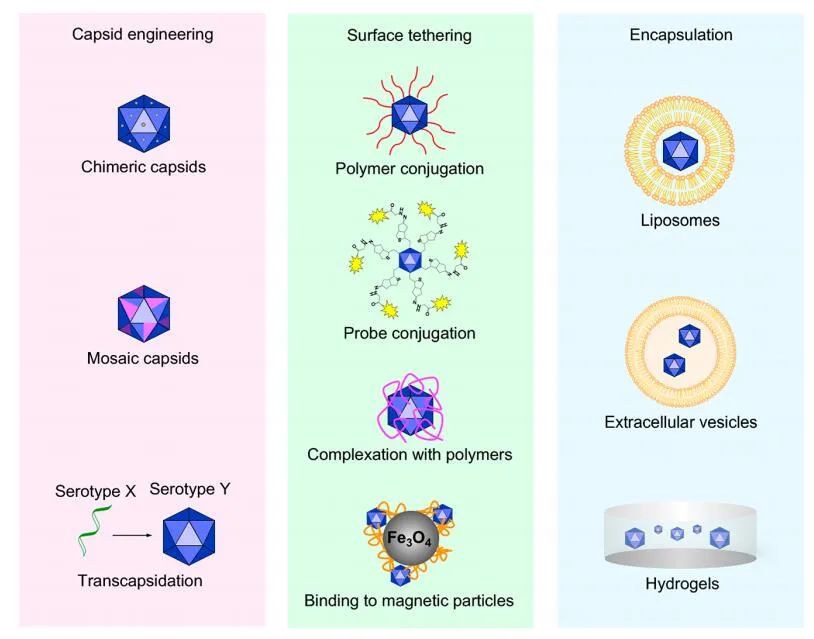
AAV工程化的一个共同目标是避免在全身给药后血液循环中被中和抗体灭活。通过修饰中和抗体的衣壳结合位点来防止中和是一种很有前途的方法。然而,这些位点中的许多对AAV的转导是必不可少的,因此在不损害其功能的前提下对其进行修饰具有挑战性。此外,使用聚合物、脂类和水凝胶的表面栓系和包封都能够保护AAV衣壳免受nAbs的侵袭,使其能够逃避免疫系统的检测和抗体反应。
AAV工程的另一个好处是通过将组织特异性配体结合到衣壳、表面偶联和包封材料来改进靶向传递和活化。从封装材料(如大孔径的硅颗粒)中被动释放aav可以延长循环时间和延长输送时间。对外界和内部刺激(如光照、pH值变化或酶降解)有反应的材料允许AAV在靶组织或细胞类型中释放或激活,而磁性粒子结合的AAV则通过施加磁场定向到靶上。

工程化AAV也可以用来克服有限的基因组大小,并结合多种治疗方式进行多模式治疗。疾病细胞中突变途径中的多个基因可以通过传递两个基因来重新编程,一个通过AAV,另一个通过表面偶联或封装的AAV载体中的第二个核酸;在组织工程支架中加入编码AAV的生长因子可以通过基因激活和结构支持促进组织再生;联合给药和AAV同时干扰异常活动和重编程病变细胞,从而产生协同治疗效果。
展望
随着全球市场上临床认可产品的出现,以及越来越多正在进行的成功临床试验,AAV正处于基因治疗的前沿,但其较小的基因组和中和抗体限制了其在许多疾病中的应用。工程化的AAV可以解决这些问题,同时提供了额外的好处,包括可控和刺激响应释放,扩展的组织定向,以及多模式联运。多模式工程化AAV解决了AAV和单一模式基因治疗的局限性,因为它们不仅扩展了治疗潜力,而且可以协同作用于疾病本身的多个方面。目前正在探索的将第二种治疗方式结合起来的工程化AAV是基因治疗的一个尚未开发的领域,可以超越传统的单一模式基因传递系统。虽然进一步的技术进步还需要推进更多的临床试验来验证,但多模式工程化AAV已经在未来的基因治疗中展现出广阔的前景。
参考文献:
1.Synthetically Engineered Adeno-Associated Virus for Efficient,Safe, and Versatile Gene Therapy Applications. ACS Nano. 2020 Oct 19.
2. clinicaltrials.gov

图片新闻
技术文库
最新活动更多
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> 【线下论坛】新唐科技2025新品发布会
-
精彩回顾立即查看>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论