南京传奇生物美股上市、国内免疫细胞领域27项药物临床试验全解读
BCMA靶点热度骤涨,第二大适应症竞争日趋激烈
药物临床试验数据显示,在国内,多发性骨髓瘤及其对应的BCMA靶点是CAR-T开发的另一个热点。传奇生物、恒润达生、普瑞金、科济制药、驯鹿医疗纷纷在此布局,其中,传奇生物已经将药物临床试验推进至II期,是为国内同类中进展最快。

国内获批免疫细胞治疗药物临床试验的适应症和阶段分布 (数据来源:动脉网整理)
BCMA是一种仅表达于多发性骨髓瘤细胞,但不会在浆细胞和成熟B细胞表达或者低表达的特异性蛋白。多发性骨髓瘤(MM)是一种克隆浆细胞异常增殖的恶性疾病,在很多国家是血液系统第2位常见恶性肿瘤,多发于老年,目前仍无法治愈。在2020年5月发布的《中国多发性骨髓瘤诊疗指南(2020年修订)》中,CAR-T疗法首次被列入难治复发性多发性骨髓瘤的治疗方案。
2018年发布的国际骨髓瘤基金统计数据显示,全球约有75万名多发性骨髓瘤患者。在我国,多发性骨髓瘤的发病率已超过急性白血病,约为十万分之一。对比不同适应症的CAR-T疗法临床试验中关于样本大小的设计后可以发现,靶向BCMA治疗多发性骨髓瘤的CAR-T药物临床试验需要入组患者数量普遍大于其他靶点和适应症的临床试验,这对原本就很难找到合适受试者的临床试验主办方并不是好消息。
实际上,BCMA赛道下的几家CAR-T开发企业,无论技术原理还是创新能力都比较比较接近。激烈竞争下,这些尚未实现盈利企业的融资能力差异在很大程度上将决定首个进入市场的商业化产品花落谁家,相信此次传奇生物美股上市给一众竞争者造成了不小的压力。
据动脉网数据库记载,恒润达生自成立以来进行了3次外部融资,累计募资超过2亿人民币,投资机构包括深创投、前海资本等;普瑞金曾于2017年公开过1次融资,从国家中小企业发展基金募集数千万人民币;驯鹿医疗则在今年3月公布了来自高瓴创投的6000万美元工资。
免疫细胞治疗的想象空间不止CAR-T
2020年1月,华大吉诺因宣布其“靶向新生抗原自体免疫T细胞注射液”临床试验申请获得国家药监局的临床试验默示许可,成为了国内首个被批准开展注册临床试验的肿瘤新生抗原细胞治疗药物。作为理论上有效性和安全性都优于CAR-T的更加前沿的免疫细胞治疗技术,肿瘤新生抗原近年来风头正劲,一波又一波国内技术团队投身相关的探索性临床研究,产出一系列喜人的临床数据在全球肿瘤学会上展示,也赢得了早期投资机构的关注。
此番华大吉诺因拿到国内首个IND批件,无疑是肿瘤新生抗原药物开发关键的阶段性胜利。更令业界振奋的是,国家药品审评中心批准华大吉诺因开展药物临床试验的适应症为新生抗原阳性的晚期实体瘤。也即是说,这是一个泛瘤种的药物临床试验。肿瘤新生抗原技术与CAR-T疗法需要将靶点与适应症对应不同,可以灵活地根据患者的具体情况,个性化地预测和定制新生抗原。跳出适应症的限制,华大吉诺因或将更容易招募受试者,达到临床终点的概率也大大提高。
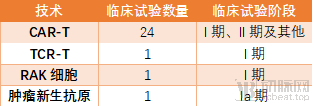
国内获批免疫细胞治疗药物临床试验的技术和阶段分布 (数据来源:动脉网整理)
在肿瘤新生抗原技术巨大的光环之下,RAK细胞和TCR-T技术略显暗淡,国内却早有在研产品跑进临床试验阶段。据公示的试验信息记载,RAK细胞临床试验由中国医学科学院肿瘤医院和宝日医生物联合申办,在中国医学科学院肿瘤医院开展I期临床试验,适应症为肾癌,于2017年9月入组第一位患者。企查查显示,宝日医生物是日本TaKaRa BIO的全资子公司,后者收购了美国BD的克隆技术部门。
唯一获得IND批件的TCR-T技术项目,是香雪精准申办的TAEST16001注射液临床试验,用于治疗以软组织肉瘤为主的晚期恶性实体瘤。中药注射液被限定使用、辅助用药目录出台等多重因素下,许多中医药或者仿制药见长的国内药企开始布局创新药,香雪制药也在这股趋势下加入了免疫细胞治疗药物的研发。
为了这项临床试验,香雪制药用了8年时间。2012年,香雪制药内部成立生命科学研究中心,并与中国科学院广州生物医药与健康研究院携手创建联合实验室,孵化出香雪精准,5年斥资1.8亿元资金用于TCR-T项目的推进。不过,由于并不具备相关的技术基础,香雪制药在设立香雪精准子公司的同时,也开放了大量环节的外部合作。例如,联合赛莱拉、金域检验、达安基因发起广州市生物产业联盟,选定金斯瑞将作为细胞治疗产品载体服务供应商,提供质粒与病毒的工艺开发、GMP质粒病毒临床样本生产等。
在这一部分,我们看到,尽管更多的前沿技术打开了免疫细胞治疗的想象空间,但无论肿瘤新生抗原,还是RAK细胞或者TCR-T技术,到最终成药进入商业化的临床用药市场,都道阻且长。
小结
通过全文分析,我们或许可以发现目前国内免疫细胞治疗药物临床试验中存在一些值得关注的趋势:
1、尽管探索性临床研究数量出现井喷,免疫细胞治疗临床试验扎堆和模仿现象比较严重,自主的知识产权和专利保护缺失可能造成负面影响;
2、适应症和疾病靶点相对集中,细分赛道中竞争压力较大;
3、研究者发起的临床研究数量庞大,但进入药物临床试验者甚少;
4、更多企业尝试从优化生产工艺、重要设备与耗材国产化的角度建立竞争优势;
5、CAR-T技术之外,更为创新技术陆续落地临床,为国内免疫细胞治疗市场注入活力。

图片新闻
技术文库
最新活动更多
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> 【线下论坛】新唐科技2025新品发布会
-
精彩回顾立即查看>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论