3个月完成15款数字疗法审批,德国是怎样实现审批高效性的?
无论从哪个角度来看,数字疗法都已经成为了医疗健康领域近来的创新之一。然而,这个全新的领域也产生了新的问题——越来越多的企业为自己打上了“数字疗法”的标签,但我国监管机构目前尚未对数字疗法提出专项的审批要求,相关的认定仍然存在一定争议。
他山之石,可以攻玉,一些数字疗法发展较早,理念上较为先进的国家或地区已经就数字疗法的审批开展了一段时间。这些国家或地区的监管机构在这个过程中积累了相当的经验和教训,并已发布相应的规范,很有参考价值。动脉网(微信号:Vcbeat)整理了德国在数字疗法上的审批情况,并整理成文。
本文将主要介绍:德国数字疗法审批现状、德国如何定义数字疗法、德国如何区分健康app和数字疗法、德国数字疗法的快速审批程序等。
75款递交申请,仅15款获正式审批——德国数字疗法的审批现状
德国联邦药品和医疗器械管理局(下文简称BfArM,系德语Bundesinstitut für Arzneimittel und Medizinprodukte简写)是德国联邦卫生部下属的独立高级机构。其作用与美国食品药品监督管理局(FDA)和我国国家药品监督管理局(NMPA)类似,主要负责药品许可及安全改善、医疗器械的检测和风险评估,以及麻醉药品的监控及麻醉药品前体的合法贩运等任务。
数字疗法的审批认定显然也属于BfArM工作的一部分。德国医疗器械审批目录中专门为数字疗法开设了DiGA目录。DiGA是德文“Digitale Gesundheitsanwendungen”的简写,意为数字健康应用(下文将用DiGA指代德国数字疗法)。BfArM认为DiGA包含了广泛的可能性,如疾病诊断和治疗、自我驱动的健康生活习惯,有望成为病人手边的数字助理。
动脉网就德国DiGA审批的一些细节采访了迈渤医健创始人陈粟源博士及联合创始人左思敏女士。迈渤医健自创始以来一直积极推动中欧科技交流和跨境项目合作,面向医疗健康领域前沿和临床需求,为客户提供行业资讯、企业跨境交流平台和商务及技术咨询服务。
陈粟源博士认为,德国数字健康应用(DiGA)的兴起很大程度上源于两个方面的原因。“一方面是德国面临人口老龄化的长期挑战,在慢性疾病管理方面的需求日益增加;另一方面则是数字医疗技术的快速发展,而缺少专门的法律法规监管。”
由于DiGA与传统的软件应用审批并不能完全划等号,在经过一段时间的摸索后,在基于《德国社会法典第五编:法定健康保险》(Fünftes Buch Sozialgesetzbuch,简称SGB Ⅴ)第139e节精神的指导下,BfArM为DiGA设计了专门的快速审批程序(The Fast-Track Process for DiGA)。
2020年5月27日,DiGA快速审批程序开始正式实施,迄今为止刚过一年时间。截至2021年6月2日,共有75款应用通过DiGA快速审批程序提交了申请。这其中,申请临时审批的应用有52款,另有23款应用则申请正式审批。这75款应用中有15款应用获批,4款应用评价不佳,另有33款应用的开发者在申请后主动撤回申请,正在处理中的应用则有23款。
陈粟源博士认为,DiGA的快速审批程序带来了多方面的影响。德国的全民医保体系具有极强的支付能力,DVG的通过为DiGA市场提供了强劲的发展动力,相关企业对此持欢迎态度。尽管保险公司需要为此支付,但出于促进市场规范和公平市场竞争的考虑,保险公司对此也表示欢迎。
相对而言,医生和病人的态度比较谨慎。“很多医生对于该方案并不熟悉,对于DiGA也持比较谨慎的态度。他们认为DiGA能在多大程度上帮助病人并不清楚。此外,他们也担心法规有可能并不完善,随着更多企业的进入会导致一定的混乱。”
“至于患者,尽管对DiGA可以帮助到疾病的管理和治疗感到兴奋,但是他们也希望了解到一个DiGA可以达到何种效果,能多大程度改善健康。”左思敏女士补充道。
德国DiGA如何定义数字疗法?
简单来说,BfArM认为DiGA是通过欧盟CE认证,且根据欧盟医疗器械法规(MDR,下文简称Medical Device Regulation)和欧盟医疗器械指令(下文简称MDD,Medical Device Directive)的Ⅰ类和Ⅱa类医疗器械,并具有下列属性:DiGA的医疗功能应主要由软件数字功能实现;可以支持疾病的识别、监测、治疗或减轻,或者身体伤害或残障的识别、监测、治疗、减轻及补偿;可以单独面向患者,也可以同时面向患者和医疗机构。
从定义不难看出,CE认证和DiGA审批是有区别的。简单来说,通过CE认证未必可以通过德国DiGA审批;但通过BfArM审批的DiGA则一定获得了CE认证。
“现在欧盟层面尚没有关于数字疗法的一个统一的规范,但是我觉得这是未来发展的方向。从欧盟的医疗器械或药物审批来看,它其实是基于整个欧盟来做,通过欧盟的审批,然后进入到成员国家。数字疗法现在因为比较新,暂时只有德国在做这样一个专门的审批。我觉得未来欧洲层面一定会推出普适性法规,通过统一的申报程序进入整个欧盟市场。”陈博士对未来欧洲层面将会统一法案表示乐观。
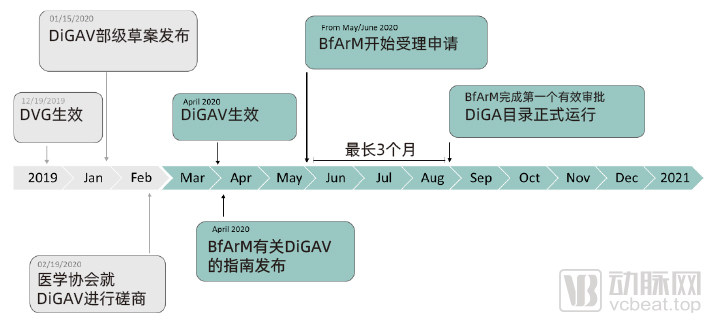
德国DiGA审批政策时间线
值得一提的是,在BfArM设立DiGA快速审批程序的时候正处于MDD和MDR的过渡期。2021年5月26日,MDR正式落地实施。后续对医疗器械的定义或分类或许会发生变化,以满足新的MDR的要求。
>>>>
DiGA是软件应用,更是医疗器械
从DiGA的定义来看,医疗器械是第一要义。BfArM为方便公众和开发者可以迅速区分普通医疗健康应用和作为医疗器械的软件应用,设定了详细可实操的指南。根据软件应用是否肯定被归为医疗器械,可以分为两种情况。此外,一旦软件应用被认定为医疗器械,其在生产制造过程中需要满足的监管基本要求即与传统的产研一体的医疗器械一样,并无例外。
第一类是可以肯定被认定为医疗器械的应用。根据德国《医疗器械法》(下文简称MPG,德语Medizinproduktegesetz的简称),智能手机app等软件应用在满足必须用于人类,并至少用于满足四类用途之一的条件下可以被归为医疗器械。
这四类情况分别是:软件应用用于诊断、预防、监测、治疗或减轻疾病;用于诊断、监测、治疗、减轻或补偿物理及心理伤害或生理缺陷;用于解剖或生理过程的调查、更换或修改;以及用于控制受孕。
总体而言,BfArM认为任何基于数据或信息介入的独立软件都可被划分为某个等级的医疗器械。不过,这并不包含仅仅用于提供知识或信息的软件,比如,电子说明书显然不是医疗器械。
第二类是可能被认定为医疗器械的应用。这些应用所宣称的用途一般包括下列字眼:报警、分析、计算、检测、诊断、解释、转换、测量、控制、监控、放大。
这其中,可以被认定为某种等级医疗器械的软件应用主要包括下列几类:提供治疗措施为代表的辅助决策应用;计算药物注射量的应用(仅仅复制一张方便用户推断注射剂量的简单表格这种方式并不在列);对患者进行监测并收集数据,且监测结果对诊断或诊疗有明显影响的应用。
需要强调的是,单纯的数据存储、存档、无损压缩、通信或简单的信息搜索应用不能被归为医疗器械。举例来说,某种专门用于数据归档的软件显然不是医疗器械。
根据软件用途简单分类,决策支持软件、软件系统、远程医疗系统、HIS、PACS属于医疗器械,操作系统软件、一般用途软件不属于医疗器械。至于健康软件应用是否被归为医疗器械则需要确定其是否准备用于医疗目的——如果其仅用于锻炼健身或营养目标,且开发者声称没有医疗目的,通常不属于医疗器械。
有意思的是,部分开发商可能试图通过“擦边球”的方式,比如在应用商店说明中简单标注“这不是医疗器械”的方式来规避监管。对此,根据MPG的规定,一旦软件应用在标签、使用说明等任意公开材料中说明或暗示了预期用于医疗的目的,其仍然会被BfArM视为医疗器械予以监管。
作为一种软件应用,DiGA需要严格遵守相关的数据安全法规。欧盟是全球在数据安全上要求最高的地区之一,也是公民最重视个人隐私的地区之一。因此,DiGA需要严格遵守相应的数据安全法令。一旦DiGA涉及德国境外的数据处理,要符合相应的法律法规。即使完成正式审批的DiGA,也可能需要根据相应数据及隐私安全规范的更新进行技术调整。否则,仍然有可能被依法取消现有审批。
“因为新冠疫情的原因,越来越多的人开始去接受相关的DiGA应用。这时必然产生一个很重要的问题,就是数据安全和隐私保护的问题。我觉得这不仅是DiGA的问题,也是未来任何相关产品或服务要进入德国市场必须考虑的问题。” 左思敏女士强调数据安全和隐私保护在德国有很高的优先度。
>>>>
DiGA绝不能对人体造成潜在的严重伤害
DiGA之所以只包含Ⅰ类及Ⅱa类医疗器械的软件应用则是从风险考虑。在欧盟,除体外诊断类和主动植入医疗器械外,基于其错误/故障可能导致的潜在损害,医疗器械被分为不同的风险类别,从Ⅰ类(低风险)到Ⅱa或Ⅱb(中风险),再到Ⅲ类(高风险)不等。
根据MDD规定,可适用于认定软件应用是否未医疗器械的数条规则中(主要包含规则9、规则10、规则12、规则14及实施规则2.3),被认定为Ⅱb类的医疗器械将可能会以一定方式对人体健康产生潜在且无法逆转的重要影响。
举例来说,规则10规定满足“用于提供被人体吸收的能量(用于在可见光谱中照亮患者身体的设备除外)、用于放射性药物体内分布成像以及用于直接诊断或监测人体重要生理过程”且用于诊断的主动设备属于Ⅱa类医疗器械。
但是,一旦这类直接诊断或监测人体重要生理过程的主动设备所监测的生理体征极为重要,可能直接导致患者陷入生命危险(如心电指标、呼吸和中枢神经活动等),则将被划为Ⅱb类医疗器械。此外,用于产生电离辐射并用于诊断和治疗的介入类放射性主动设备,以及用于控制、监测此类设备或直接影响其性能的设备(包括软件应用)均属于Ⅱb类。
根据MDD规则,智能手机和平板上的医疗应用将被划入Ⅰ类医疗器械。当然,如果其用于诊断或监测重要体征(如心电指标),则根据风险程度可能被划为Ⅱa或Ⅱb类医疗器械。一旦被划为Ⅱb类医疗器械,则将不被认定为DiGA,需要满足更高的监管要求。
也就是说,BfArM明确地认为,DiGA必须具有较高的安全性,不能对人体健康产生潜在的危险。一旦工作异常将导致使用者陷入潜在危险境地的软件应用不能被认定为DiGA。
同时,仅仅只是起到设备数据搜集传输或设备控制的软件不能被认定为DiGA;单独由医生使用来治疗患者的应用也不是DiGA——DiGA必须与患者有交互过程,如果仅仅只是从传感器或手机等设备搜集数据并直接传输给医生则不满足这一要求。
与其他软硬件或服务配合的软件应用是不是DiGA?
有时候,DiGA并不会以单独一个软件应用的形式出现,会与其他硬件、软件或者服务结合。有的情况下,这些搭配可以认定为DiGA,甚至是通过审批是必须的;有些情况则不然。BfArM根据过往的经验,对相应的可能性给出了详细的分析。
>>>>
与其他软硬件及服务的结合
DiGA具有多种形式,既可以是手机常见的app,也可以是电脑上的桌面应用或浏览器应用。它也可以与硬件或软件组合,只要其主要功能由软件应用的数字技术实现。BfArM对于DiGA与硬件与软件的联合使用是否属于DiGA给出了非常具体的参考。

DiGA与软硬件结合的认定实例
DiGA还可与额外的服务配合。原则上,类似顾问、训练或商业保险提供的额外服务可由DiGA提供或集成到DiGA的使用过程中。需要明确的是,此类额外的服务不会被医保支付。基于DiGA可以通过医保支付的前提,其审批所必需的软件应用对医疗产生积极影响的说明中不能包含此类额外服务。此外,开发者需要在与BfArM的沟通中列举出所有采用额外服务的应用场景以免发生误会。
当然,上述情况并不适用于通过医保认证的医生所提供的服务。由包括主治医生、住院医生、牙科医生或心理医生等经过医保认证的医生所提供的,与DiGA用途关联的服务则由医保以医生服务的方式予以支付。因此,这些服务可以作为DiGA审批所需资料的一部分。
如果医保认证医生的服务可以通过文字描述包含在DiGA使用流程中,或者也可以直接列出医保支付所需的EBM编码(大多数情况下,德国医保的每项支付均有独立的EBM编码)。需要注意的是,这些服务必须是由医保认证医生提供且提交报销凭证,否则将无法获得医保支付。

DiGA与服务结合的认定实例
对于互联网医疗与DiGA的关联,BfArM认为如果主要功能由软件数字技术实现,则互联网医疗应用是DiGA的一部分,但单纯的互联网医疗平台不能被认定为DiGA。就包含的范围来看,DiGA>互联网医疗。当然,个别的特殊情况需要与BfArM沟通后才能确定。

图片新闻
技术文库
最新活动更多
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> 【线下论坛】新唐科技2025新品发布会
-
精彩回顾立即查看>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论