用于肿瘤免疫治疗的新一代细胞因子
关注小药说药,一起成长!
前言
白介素和相关细胞因子是先天性和适应性免疫细胞以及非免疫细胞和组织的通讯手段。因此,细胞因子在癌症的发生、发展和控制中起着关键作用,一些细胞因子与癌症的发生和发展特别相关。此外,细胞因子是有效的免疫调节蛋白分子,它们刺激自然杀伤细胞(NK)和T细胞的功能、存活和增殖,从而介导针对肿瘤的免疫反应。
细胞因子的这些特性可以用来改善免疫治疗以提高疗效和限制副作用。近年来,细胞因子的治疗潜力一直是肿瘤基础和转化研究的热点。目前,新一代的细胞因子设计提高了半衰期、肿瘤靶向性和抗肿瘤疗效,正在进行的越来越多的临床试验凸显了它们作为治疗药物和靶点的价值。
1型干扰素-α
I型干扰素,包括IFN-α、IFN-β、IFN-ε、IFN-κ和IFN-Ⅴ,是一个具有多种功能的单体细胞因子家族。IFN-α调节调节肿瘤细胞生长、增殖、凋亡和免疫检查点介导的免疫抑制的各种基因的表达。一些研究还表明,I型干扰素通过促进树突状细胞(DC)启动以激活T细胞,在肿瘤控制中发挥关键作用。FDA已批准IFN-α治疗血液系统恶性肿瘤和黑色素瘤。
然而,IFN-α依然存在一些局限性,需要进一步提高其临床疗效和安全性。一种IFN-α变体通过将聚乙二醇(PEG)与IFN-α结合提高了IFN-α的半衰期,聚乙二醇化IFN-α的生物活性与IFN-α相当,但血浆半衰期延长约10倍,因此给药频率和患者负担较低。IFN-α聚乙二醇化产生的这些显著益处已被批准用于黑色素瘤的辅助治疗。然而,聚乙二醇化IFN-α仍然可以诱导毒性副作用,聚乙二醇化IFN-α2b辅助治疗与严重的宿主毒性相关,包括疲劳(97例,16%)、肝毒性(66例,11%)和抑郁症(39例,6%)。总的来说,37%的患者因为这些副作用而停止辅助治疗。这些研究表明,聚乙二醇化IFN-α缺乏肿瘤靶向性可能限制其临床应用。
因此,人们开发了各种策略来增加IFN-α向肿瘤部位的传递,以提高疗效并降低毒性。一项关于过表达人CD20的B细胞淋巴瘤异种移植模型治疗的临床前研究报告显示,与抗CD20抗体融合连接的I型IFN通过直接杀死IFN-α敏感的hCD20肿瘤细胞增加了I型IFN的抗肿瘤作用。另一项研究表明,用共轭连接的抗CD20/IFN-α融合蛋白治疗可消除B细胞淋巴瘤对抗CD20的耐药性,同时限制宿主中IFN相关的全身毒性。
此外,将亲和力降低的干扰素蛋白与高亲和力肿瘤靶向抗体结合,可进一步诱导此类融合蛋白优先定位于肿瘤,从而降低非靶向毒性。据报道,IFN-α的减毒形式以MLepR靶向纳米体或抗CD38抗体的融合降低了对正常细胞的结合和毒性。用CD38靶向减毒IFN-α治疗已建立的人类多发性骨髓瘤荷瘤小鼠可完全消除此类肿瘤。因此,与野生型IFN-α或IFN-α融合蛋白相比,使用更高剂量的抗CD38/减毒IFN-α治疗患者可能更安全。
γ链细胞因子家族:IL-2、IL-15和IL-12
常见的γ链细胞因子家族对T淋巴细胞的存活、功能和增殖具有多种功能。该家族由六名成员组成,包括IL-2、IL-4、IL-7、IL-9、IL-15和IL-21。
IL-2
IL-2是FDA批准的首批用于转移性黑色素瘤和肾细胞癌的免疫细胞因子之一。临床IL-2免疫治疗由于其体内半衰期短、治疗剂量下的严重毒性以及通过调节性T细胞(Treg)扩增诱导免疫抑制而未得到广泛应用。
目前,人们已经设计开发了了几种第二代IL-2变体以降低对IL-2Rα的亲和力或增加对IL-2Rβ的亲和力。NKTR-214是在IL-2Rα结合位点进行聚乙二醇化的人IL-2前体药物,其中六个PEG残基缓慢释放,形成活性稳定的人IL-2。由于与IL-2共轭的PEG分子阻断IL-2与IL-2Rα的结合,PEG-IL-2与Treg细胞的结合受到抑制,而IL-2与CD8+T细胞上受体的结合不受影响。与重组IL-2(Aldesleukin)相比,NKTR-214显著增加了小鼠黑色素瘤模型中CD8+T细胞与Treg细胞的比率,并增强了抗肿瘤效果。然而,NKTR-214作为单一疗法在实体瘤中的疗效有限。
最近,另一种IL-2Rα亲和力改变的突变体可降低IL-2介导的毒性,该突变体被设计在R38、F42、Y45和E62残基上突变,这些残基均与IL-2Rα结合,被丙氨酸取代。研究表明,降低IL-2对IL-2Rα的亲和力有助于提高抗肿瘤疗效。
为了增强IL-2向肿瘤部位的递送,许多团体尝试了基于抗体的肿瘤靶向IL-2。默克公司开发了NHS-IL2LT(LT代表低毒性),它包含一种IL-2(D20T)变体,与针对肿瘤坏死核心的抗体(NHS76)融合。迄今为止,NHS-IL2LT在所有IL-2变体的临床试验中显示出最低的毒性。罗氏制药公司开发了CEA-IL2v,它将IL-2 突变体与针对癌胚抗原(CEA)的抗体融合。突变体包括IL-2Rα亲和力降低的突变F42A、Y45A和L72G。然而,CEA-IL2v由于在临床试验中缺乏疗效而被放弃。相比之下,在I期剂量递增研究中,皮下注射DI-Leu16-IL2(抗CD20抗体与野生型IL2融合)有数个完全响应,且几乎没有副作用。另一种被称为SumIL2的IL-2/抗体融合蛋白结合了F42A(一种IL-2Rα亲和力降低突变)和IL-2超因子突变,与EGFR靶向抗体融合。在临床前模型中,这种融合蛋白对过表达EGFR的小鼠肿瘤诱导了比SumIL2与对照抗体融合更有效的抗肿瘤效果。
另外一些研究旨在掩盖通常首先与IL-2结合的IL-2Rα。ALKS 4230通过接头将IL-2与IL-2Rα连接起来,设计用于选择性激活中间亲和力的IL-2R。已观察到ALKS 4230在小鼠中比野生型IL-2更有效地降低外周毒性和抑制B16黑色素瘤转移。另一个例子涉及将IL-2络合到IL-2单克隆抗体,研究人员专门使用了一种与IL-2的IL2Rα结合区强结合的IL-2抗体,从而产生了一种无法与内源性IL2Rα结合的IL-2/mAb复合物。与野生型IL-2相比,这种IL-2Rβ优先的IL-2/mAb复合物可以更有效地扩增CD8+T细胞并抑制原发性肿瘤生长。其他的一些IL-2变体还包括RO6874281,RO7284755,Darleukin等。
IL-15
与IL-2相比,IL-15不会导致Treg细胞的扩增,同时具有类似的免疫刺激特性。
ALT-803 是另一种包含IL-15 突变体(IL-15N72D)和IL-15RαSu/Fc的二聚体蛋白,已被证明在小鼠模型中具有优异的抗肿瘤活性。在第一个人类I期试验(NCT01885897)中,ALT-803治疗具有良好的耐受性,在19%的血液恶性肿瘤患者观察到临床反应。最近进行了另一个剂量递增 I 期试验,评估 ALT-803联合nivolumab 治疗晚期非小细胞肺癌(NSCLC)患者的安全性和有效性(NCT02523469);未记录剂量限制性毒性,21 名患者中有 6 名获得客观响应。正在进行第二阶段患者的连续招募。
BJ-001 是由博际生物自主研发并拥有全球专利的世界首个肿瘤靶向性 IL-15 融合蛋白。其设计不仅克服了重组 IL-15半衰期短的缺点,更重要的是通过其结构域中的肿瘤靶向分子使其在αvβ3,αvβ5 和αvβ6 整合素高表达的肿瘤中富集,从而具有降低系统毒性,增强疗效的潜力。
IL-12
IL-12具有显著的免疫激活和肿瘤控制作用,但在诱导抗肿瘤作用所需的剂量下会引起严重的不良反应。然而,靶向给药策略使IL-12在肿瘤部位达到高浓度,同时避免全身反应,又激发了人们对IL-12在癌症治疗的兴趣。
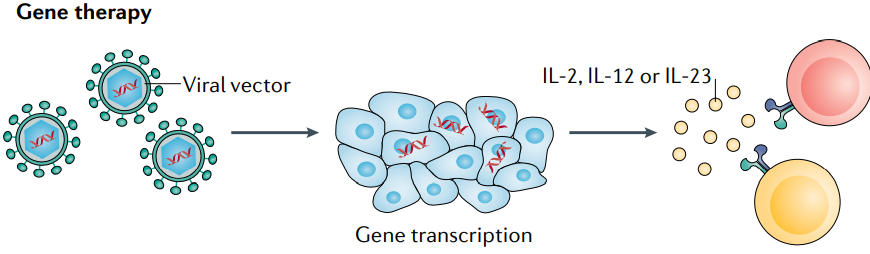
基因治疗可以更好地控制治疗方案中白介素的定位和数量。Tavokinogene telseplasmid是一种IL-12编码质粒,电穿孔到黑色素瘤病灶中,在II期试验中ORR为36%,CR为18%。值得注意的是,46%的患者在至少一个未注射Tavokinogene telseplasmid的病灶中出现消退,25%的患者在所有未注射Tavokinogene telseplasmid的病灶中出现消退,这表明诱导了全身的抗肿瘤免疫。此外,与pembrolizumab联合应用,ORR提高到41%,CR为36%。
CBD-IL-12是一种由IL-12和胶原蛋白结合域组成的融合蛋白。肿瘤血管紊乱中会暴露胶原蛋白,CBD-IL-12因此会在肿瘤中积聚,通过肿瘤部位免疫系统的广泛激活,显示出优于IL-12的抗肿瘤作用。
此外,还有多功能溶瘤纳米颗粒,目的是同时发送几种不同的信号触发抗肿瘤反应。研究表明,含有自复制RNA组成的纳米颗粒可诱导肿瘤细胞死亡,因为所含RNA作为病原体识别受体的信号,并编码IL-12,进一步增强诱导免疫应答。
小结
总的来说,细胞因子单一疗法仍然面临着很大的局限性,最近出现了许多新的策略设计新一代细胞因子来解决这些问题。这一趋势正在从应用细胞因子的天然形式转向复杂的工程化方法,涉及改变靶细胞群的受体亲和力或设计肿瘤靶向融合结构以提高疗效和减少全身毒性作用。此外,为了提高细胞因子治疗的应用率,联合治疗越来越重要。细胞因子治疗可以释放其他疗法的潜力,从而帮助耐药患者从中受益。
总之,细胞因子是协调TME和控制肿瘤-免疫细胞相互作用的关键元素,新一代细胞因子治疗癌症已经在临床前和临床研究方面取得大量令人兴奋的新进展,细胞因子在肿瘤免疫治疗中的前景未来可期。
参考文献:
1.Interleukins in cancer: from biology to therapy. Nat Rev Cancer. 2021 Jun 3 : 1–19.
2. Next-generation cytokines forcancer immunotherapy. Antib Ther. 2021 Apr; 4(2): 123–133.

原文标题 : 用于肿瘤免疫治疗的新一代细胞因子

图片新闻
技术文库
最新活动更多
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> 【线下论坛】新唐科技2025新品发布会
-
精彩回顾立即查看>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享






















发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论