神州细胞登陆科创板,开盘暴涨超200%
亿欧大健康6月22日消息,今日生物药企业北京神州细胞生物技术集团股份公司(以下简称“神州细胞”)赴上海证券交易所科创板上市交易,股票代码“688520”,发行价25.64元/股。上市首日,神州细胞开报85元/股,股价涨幅235.34%。截止发稿前,总市值达366.99亿元。在上市前,其估值就已超过110亿元。
据招股书披露,此次募集资金主要用于产品临床研究项目,其次是作为补充流动资金。
神州细胞创立于2007年,专注于恶性肿瘤、自身免疫性疾病、感染性疾病和遗传病等多个治疗和预防领域的生物药产品研发和产业化,是国内最早从事生物药研发的企业之一。神州细胞致力于通过研发在临床上具有差异化竞争优势的同类最佳(Best-in-Class)或“Me-better”创新生物药产品,并已建立覆盖生物药研发和生产全链条的高效率、高通量技术平台。
23款药物在研,广纳明星靶点
我国生物药市场将逐渐增长,预测2025年我国生物药市场规模达8332亿元。2000-2015年我国生物制药行业大中型企业新产品产销规模呈较快增长趋势,随着生物医药产业技术不断突破、健康中国2030等政策不断出台。据IQVIA预计,到2020年,我国生物医药市场将成为仅次于美国的全球第二大生物医药市场。
谢良志毕业于麻省理工,曾是默克公司的病毒疫苗研发和生产领域专家,2002年回国前,他所领导建立的全球领先的腺病毒载体艾滋病疫苗生产工艺,该工艺目前仍是人用活病毒疫苗全球规模最大的细胞培养和病毒生产工艺。
回国后,谢良志先后创立了神州细胞和义翘神州。2009年甲流疫情肆虐之际,义翘神州团队仅用30天时间便研发出了甲流疫苗所必需的血凝素蛋白;2013年,中国突发H7N9禽流感疫情,义翘神州和神州细胞团队仅用12天时间就完成了H7N9的血凝素蛋白生产,仅用6天筛选出中和抗体,6天完成抗体的人源化研究,仅用7个月就完成了原创抗体应急药物的全部临床前研究、1.5公斤应急抗体药物的GMP生产储备及临床申报资料准备。
目前,神州细胞重点研究的疾病领域是肿瘤,牛皮癣、关节炎等自身免疫性疾病和血友病、多发性硬化症等罕见病。重点研发的产品类别是单克隆抗体、重组蛋白药物以及疫苗。谢良志曾在采访中表示:“神州细胞现在研发的生物药都是国内临床急需的大品种药品。以淋巴瘤为例,有数据显示,我国每年新发淋巴瘤约9万人,每年死亡约5万人,进口靶向抗体药物的费用约为15万至20万一个疗程,如此高昂的费用只有10%左右的患者用得起,临床需求巨大。”
然而一如大多创新药企业,神州细胞仍处于持续亏损的状态,部分原因是因其仍处于高研发投入期。招股说明书显示,2016年至2019年,神州细胞的研发费用分别为1.2亿元、1.89亿元、4.35亿元及5.16亿元。与此同时,公司研发人员的数量从2016年的334人增加到如今的657人,占公司总人数的75.43%。如此“兴师动众”的研发投入背后,是神州细胞丰富的产品线。
截至2020年5月15日,神州细胞独立自主研发的处于临床阶段和临床前研究阶段的产品管线包括21个创新药和2个生物类似药品种。其中,1个品种的首轮上市申请和1个品种的上市申请已获国家药品监督管理局受理,正在开展7项III期临床研究、5项II期临床研究、6项I期临床研究、2项临床研究准备工作以及16项临床前研究。神州细胞产品管线不乏一些热门的明星靶点,例如PD-1单抗、CD20、CD38、CD47等。
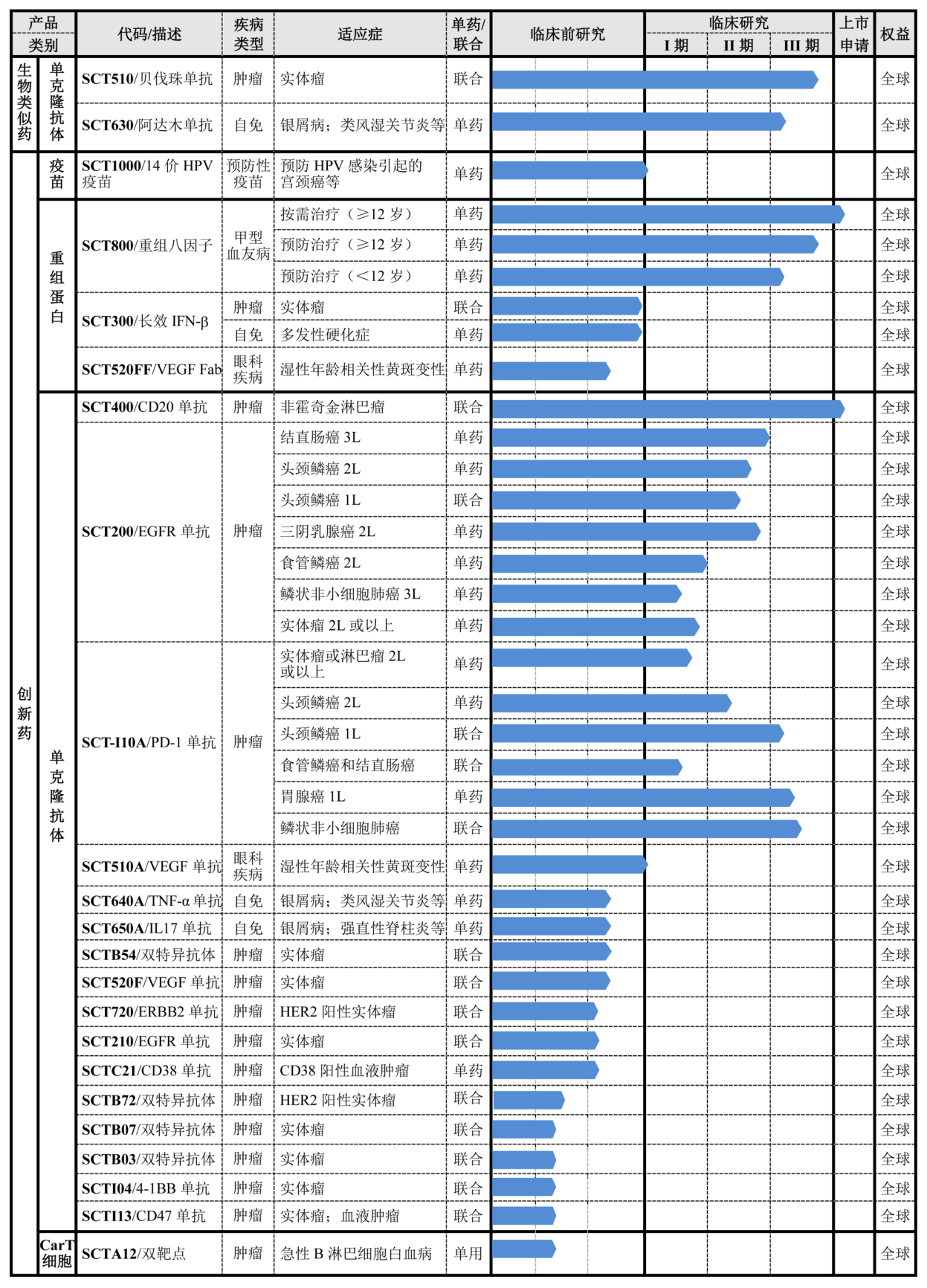
神州细胞的主要产品有重组八因子药、EGFR单抗药、PD-1单抗药、CD20单抗药、VEGF单抗药、阿达木单抗药和14价HPV疫苗。其中,已经提交上市申请的有重组八因子和CD20单抗药。
两款药物已提交上市申请
神州细胞从2008年开始自主研发重组八因子药物,该药物用于治疗甲型血友病,今年5月15日,神州细胞向CDE提交的首轮上市申请已获得药监局受理,同时重组八因子的儿童、成人及青少年预防治疗III期临床研究正在进行中。这是目前国内首个提交上市申请的国产重组凝血八因子产品,其分子专利溯源至回八十年代初期,由于其分子量大、结构不稳定而被成为“最难生产的药品”。
据招股书,神州细胞的重组八因子药物比活性达到7590-13340IU/mg蛋白,高于相关国内外同类产品比活标准(例如,任捷的比活性为5500-9900IU/mg蛋白;百因止的比活性为4000-10000IU/mg蛋白,我国对血源性八因子制定的比活标准为不低于10IU/mg蛋白)。
智研咨询的报告显示,2018年,全球甲型血友病患病人数达64.47万人,同比增加1.19万人;中国甲型血友病患病人数11.9万人,同比2017年增加了0.08万人。预计2023年,中国的血友病药物市场将达到达到55.2亿元,至2030年达到141.0亿元。
八因子药物是甲型血友病患者的特效药和必备药,一旦用药不够,病人将会出血难止、疼痛难忍,甚至有残疾、死亡的风险。但这样的救命药,却因为工艺复杂、生产难度高,在全球一直供应不求,供需矛盾巨大,并且价格极其昂贵(美国病人平均每年治疗费用20~30万美元)。目前国内已经上市的重组八因子产品均为进口产品,其价格及年治疗费用均相对较高,且供应不稳定。
国内有5款产品已获批上市,包括拜耳医药的注射用重组人凝血因子Ⅷ(拜科奇,2007年在国内上市)和重组人凝血因子Ⅷ(科跃奇,2019年在国内上市)、百特公司的重组人凝血因子Ⅷ(百因止,2012年在国内上市)、辉瑞的注射用重组人凝血因子Ⅷ(任捷,2013年在国内上市)、罗氏的艾美赛珠单抗(舒友立乐,2018年在国内上市)。除艾美赛珠单抗外全部上市药品均已纳入医保。
除了已上市的产品,还有诺和诺德、绿十字、辉瑞所研产品已经提交上市申请,Octapharma、正大天晴、赛诺菲、蓉生药业的产品正在进行III期临床试验,开封制药的产品正在进行I期临床试验。
神州细胞另一款已经提交上市申请的药物是CD20单抗药,药物拟用于治疗非霍奇金淋巴瘤,截至2020年5月15日,CD20单抗药的上市申请已获国家药品监督管理局受理。
中国非霍奇金淋巴瘤的新发病例数呈增长趋势。根据统计及预测,2023年,中国非霍奇金淋巴瘤的发病患者数将以1.9%的年复合增长率增长至9.2万人,并在2023年之后以2.0%的年复合增长率保持增长,预计至2030年,中国非霍奇金淋巴瘤的新发病例数将达到10.6万人。
CD20产品的竞品较多,其中,2000年在国内获批的罗氏利妥昔单抗(美罗华)和2019年获批的复宏汉霖利妥昔单抗(汉利康)已经双双被纳入医保。
在美国上市的生物制品类抗CD20靶点的药物实体共有6个,包括两个鼠抗体偶联同位素的药物。其中利妥昔单抗美罗华以先发优势强势占领市场,在2018年的总销售额接近70亿美元。招股书中已有研究结果显示,神州细胞的CD20单抗药在安全性、药代动力学、临床疗效等方面与美罗华高度相似。
目前,同样已经提交上市申请的有信达生物的利妥昔单抗和罗氏的奥妥珠单抗产品,并且两款产品均已纳入优先审评。除此之外,海正药业、嘉和生物、正大天晴、华兰生物、上海生物制品研究所这5家公司的产品正在开展的III期临床试验,天广实正在开展的II期临床试验,万乐药业、上海医药等7项正在开展的I期临床试验。
此外,神州细胞的VEGF单抗药、阿达木单抗药、创新药重组八因子药、CD20单抗药、PD-1单抗药已经进入III期临床试验。虽然产品管线丰富,但神州细胞主要产品的多项竞品已实现多年的销售记录,占据了一定的市场销售份额,部分竞品已经进入医保目录,而神州细胞的主要产品尚未实现商业化,因此将面临一定的竞争压力。
作者: 高雨杉

图片新闻
技术文库
最新活动更多
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> 【线下论坛】新唐科技2025新品发布会
-
精彩回顾立即查看>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论